Фарматека №s5-16 / 2016
13С-метацетиновый дыхательный тест при оценке функционального резерва печени
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава РФ,
Санкт-Петербург
В связи с увеличением числа хронических заболеваний печени необходим пересмотр существующих методов скрининг-диагностики данной патологии. Ни один из широко применяемых методов не дает представления о функциональном резерве печени. Современные неинвазивные методы диагностики, в первую очередь 13С-метацетиновый дыхательный тест, смогут решить данную проблему. Необходимо изучить возможности указанных методов диагностики, а также определить их место в диагностике хронических заболеваний печени на современном этапе.
Введение
Печень выполняет множество функций, включая синтетическую, дезинтоксикационную, барьерно-защитную, кроветворную, эндокринную, участвует в регуляции метаболического, антигенного и температурного гомеостаза организма. Она обладает большими резервными возможностями, клинические признаки нарушения функций печени проявляются при потере значительной части ее клеточной массы, когда наступившие изменения становятся, как правило, необратимыми. В связи с этим для клинической практики необходимы скрининговые тесты для оценки функционального состояния печени.
Наиболее частыми причинами хронических заболеваний печени (ХЗП) являются вирусы гепатита В и С, злоупотребление алкоголем, нарушение жирового обмена и сахарный диабет, приводящие к развитию неалкогольной жировой болезни печени (НАЖБП). Нередко эти факторы присутствуют у одного и того же больного, что ускоряет прогрессирование болезни.
В мире насчитывают более 2 млрд носителей различных вирусов гепатита. Из них около 400 млн человек страдают хроническим гепатитом В и около 170–200 млн – хроническим гепатитом С [43]. У четверти пациентов со стеатозом печени развивается фиброз печени (ФП) [1]. В ряде исследований показано, что в 10% случаев в течение примерно 10 лет стеатоз печени прогрессирует в неалкогольный стеатогепатит (НАСГ). В 5–25% случаев НАСГ трансформируется в цирроз печени (ЦП). Установлено, что 60–80% всех криптогенных ЦП являются исходами НАЖБП [17], а направление на трансплантацию печени в 10% случаев обусловлено цирротической стадией НАСГ. Следует отметить, что пациенты с НАЖБП и другими ХЗБ – группа риска развития гепатоцеллюлярной карциномы [20, 25]. Развитие последней наблюдается приблизительно у 10% пациентов с цирротической стадией НАСГ в течение 10 лет [30].
ХЗБ чаще страдают люди трудоспособного возраста, и они приводят к длительным периодам временной трудоспособности и инвалидизации. Поэтому эффективные профилактика и лечение ХЗБ – важнейшая задача здравоохранения как в России, так и за рубежом. При этом существует проблема ранней диагностики нарушения функций печени, решение которой может способствовать более своевременному и успешному лечению пациентов с ХЗБ. Ни один из современных методов диагностики не дает информации о функциональном состоянии (резерве) печени.
Современные методы диагностики заболеваний печени
На сегодняшний день в клинической практике при ХЗП используются следующие методы исследования:
- Лабораторные тесты (биохимический анализ крови с оценкой «печеночных проб»).
- Инструментальные методы: ультразвуковое исследование органов брюшной полости, гастроскопия, компьютерная томография, магнитно-резонансная томография.
- Методы оценки стадии ФП: пункционная биопсия печени (ПБП), фибротесты, фиброэластометрия.
- Расчетные прогностические индексы: APRI, FIB–4, MELD, FibroFast, FibroIndex, FibroMeter, Hepascor.
Наиболее востребованными в клинике с точки зрения прогноза, а также выбора тактики лечения являются методы, определяющие стадию ФП. ПБП – метод, который считают эталонным для определения стадии ФП и активности воспаления [8]. В настоящее время прижизненное морфологическое исследование ткани печени продолжает широко применяться. Используемые до настоящего времени методы функциональной диагностики не в состоянии дать ответ на вопросы о действительном характере морфологических изменений печени при различных ее поражениях. ПБП позволяет подтвердить, уточнить, а нередко и изменить клинический диагноз [46]. При этом следует отметить, что метод обладает высокой специфичностью (81–99%), но недостаточно высокой чувствительностью (36–57%) [7].
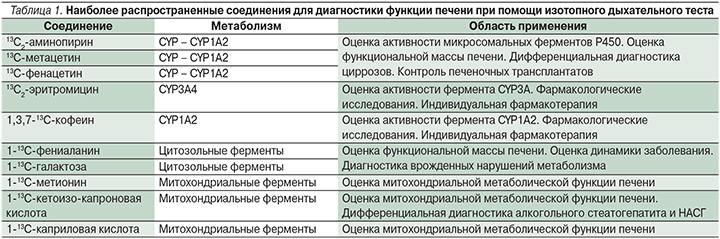
К сожалению, данная методика является инвазивной, может приводить к развитию таких осложнений, как внутрибрюшное кровотечение (0,24%) [26], внутрипеченочная гематома (2%) [13], пневмоторакс (0,08%) [53], желчный перитонит (0,04%) [38], летальный исход (0,01%) [55], местное метастазирование при прицельной биопсии злокачественных опухолей (0,0005%) [53]. Причиной невозможности проведения ПБП также является страх пациентов перед процедурой. Страх болевых ощущений в месте прокола и побочные эффекты на анестезию заставляют до трети больных отказаться от выполнения ПБП. Это приводит к замедлению принятия решения о начале специфической терапии и продлению сроков госпитализации [23, 32].
Кроме того, следует указать на требования к количеству материала при ПБП, несоблюдение которых может приводить к недостаточно корректным заключениям: длина столбика печеночной ткани должна составлять >15 мм, а количество портальных трактов – не менее 6–8 [2, 10]. Следует подчеркнуть, что ПБП не дает информации о функции печени.
В последние годы в клинической практике получили широкое распространение такие неинвазивные методы оценки ФП, как эластометрия и фибротесты.
К факторам, лимитирующим применение эластометрии, относятся индекс массы...












