Терапия №3 / 2022
Анализ отдаленных результатов эффективной этиотропной терапии хронического гепатита С
1) ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России;
2) ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера» Роспотребнадзора;
3) СПб ГБУЗ «Клиническая инфекционная больница им. С.П. Боткина», г. Санкт-Петербург
ВВЕДЕНИЕ
Успехи современной противовирусной терапии хронического гепатита С (ХГС) требуют разработки критериев выздоровления от инфекции вируса гепатита С (ВГС) и оптимизации диспансерного наблюдения за пациентами после лечения. Маркером эрадикации вируса на сегодняшний момент служит устойчивый вирусологический ответ (УВО), который доказано ассоциируется со снижением риска развития печеночной недостаточности и улучшением выживаемости по сравнению с нелечеными пациентами и больными с неудачей лечения независимо от схемы противовирусной терапии [1, 2]. УВО определяется как отсутствие РНК ВГС в крови с чувствительностью тест-системы 10 МЕ/мл через 12–24 нед после окончания терапии [3]. Тем не менее риск прогрессирования фиброза печени и развитие гепатоцеллюлярной карциномы (ГЦК) даже после достижения УВО сохраняется. В обширном обзоре Negro F. подчеркивается необходимость разработки более четких рекомендаций для стратификации уровней риска неблагоприятных событий у пациентов после лечения, особенно в условиях упрощения мониторинга пациентов до, во время и после терапии, что оправдано из-за экономических соображений, но может быть преждевременным в отношении сложных пациентов, требующих персонифицированного подхода [4].
В контексте возможности снятия диагноза у пациентов, достигших УВО, и их безопасности в эпидемиологическом отношении (как источников инфекции) актуальным становится вопрос о скрытой инфекции ВГС (СкИ ВГС). Это понятие введено в 2004 г. и определяется как наличие РНК ВГС в гепатоцитах или мононуклеарных клетках периферической крови (PBMC) без обнаруживаемой РНК ВГС в сыворотке [5].
Существование СкИ ВГС среди населения в целом и в отдельных клинических группах освещено в литературе [6], но последствия его в различных клинических ситуациях требуют дальнейшего изучения. Терапевтическая тактика в случае СкИ ВГС также не понятна. Частота СкИ ВГС среди пациентов, достигших УВО после использования препаратов прямого противовирусного действия (ПППД), только начинает изучаться.
Цель исследования – оценить отдаленные исходы ХГС и встречаемость СкИ ВГС у пациентов после успешной противовирусной терапии.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 182 пациента от 18 до 87 лет, которые, в соответствии с маршрутизацией пациентов с ХГС, были направлены специалистами первичного звена на обследование и лечение в дневной стационар СПб ГБУЗ «Клиническая инфекционная больница им. Боткина» в 2017–2020 гг.
Всем пациентам определялись генотип ВГС, уровень вирусной нагрузки, активность печеночных трансаминаз, уровни альбумина, общего билирубина, креатинина, протромбинового индекса (ПТИ), альфа-фетопротеина (АФП), выполнялись эзофагогастродуоденоскопия (ЭГДС) для оценки варикозного расширения вен пищевода, ультразвуковое исследование (УЗИ) органов брюшной полости. Плотность печени измерялась в кПа при помощи эластометрии на аппарате «Фиброскан» (Fibroscan). Оценку стадии фиброза печени производили при помощи шкалы METAVIR: F0 – отсутствие фиброза (≤5,8 кПа); F1 – фиброз портальных трактов (слабый фиброз: 5,9–7,2 кПа); F2 – фиброз с немногочисленными септами (умеренный фиброз: 7,3–9,5 кПа); F3 – фиброз с многочисленными септами (выраженный фиброз: 9,6–12,5 кПа); F4 – цирроз печени (>12,5 кПа).
К критериям исключения относился возраст <18 лет.
Исходные характеристики пациентов представлены в таблице 1.
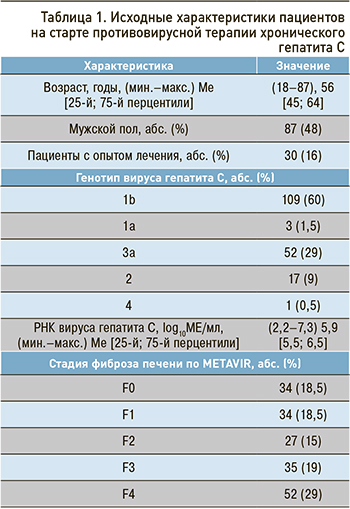
Длительность лечения составляла 8, 12, 24 или 48 нед. Схемы противовирусной терапии были следующими: 17 (9%) пациентов получали даклатасвир + асунапревир, 38 (21%) – софосбувир + даклатасвир ± рибавирин, 3 (1,5%) – софосбувир + ледипасвир, 35 (19%) – паритапревир + ритонавир + омбитасвир + дасабувир, 27 (15%) – софосбувир + велпатасвир ± рибавирин, 25 (14%) – глекапревир + пибрентасвир ± софосбувир, 3 (1,5%) – гразопревир + элбасвир, 2 (1%) – даклатасвир + нарлапревир + ритонавир, 20 (11%) – пэгинтерферон + нарлапревир + ритонавир, 12 (7%) – пэгинтерферон + рибавирин.
Все пациенты достигли УВО, который был определен как отсутствие РНК ВГС в сыворотке крови через 24 нед после окончания терапии. После терапии пациенты со средней периодичностью в 6–12 мес направлялись врачами-инфекционистами поликлиник для прохождения обследования в дневной стационар. Медиана времени от окончания лечения до последнего визита в дневной стационар составила 99 [25-й перцентиль – 56; 75-й – 130] нед.
В последней точке наблюдения 109 пациентам было выполнено тестирование на СкИ ВГС методом ПЦР с предварительной подготовкой клинического материала. Тотальную РНК выделяли из: а) плазмы крови после концентрирования вируса ультрацентрифугированием в течение 1 ч при 24 000g, +40 °С; б) лейкоцитарной фракции крови; в) мононуклеарных лейкоцитов периферической крови, выделенных в градиенте плотности посредством центрифугирования на FicollPaque.
Клинико-лабораторные показатели сравнив...












