Фарматека №11 / 2020
Эндокринорезистентность при лечении рака молочной железы
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Согласно Консенсусу Сан-Галлен, эндокринно-чувствительный рак молочной железы (РМЖ) определяется экспрессией положительных стероидных рецепторов. Такой рак является наиболее распространенным подтипом РМЖ. Доступные данные предполагают, что чем выше экспрессия ER и PR, тем лучше исход для пациентов с ранним и распространенным РМЖ. Лечение ER+-РМЖ включает вмешательства (называемые эндокринной терапией), которые подавляют выработку эстрогена и/или напрямую воздействуют на ER. Хотя эндокринная терапия значительно снизила рецидивы и смертность от РМЖ, de novo и приобретенная резистентность к этому лечению остаются серьезной проблемой. Сообщается о растущем числе механизмов эндокринной резистентности, включая соматические, эпигенетические изменения и изменения в опухолевом микроокружении. В статье приведен обзор литературы о сигнальных путях, регулирующих опухолевый рост, механизмах развития эндокринорезистентности и о возможных путях ее преодоления.
Введение
Несмотря на огромный прорыв в лечении рака молочной железы (РМЖ), произошедший за последние десятилетия, мы продолжаем сталкиваться с неудовлетворительным ответом на лечение от многих пациентов. При этом более 2/3 случаев РМЖ относятся к люминальным подтипам (имеющим экспрессию ER – рецептор эстрогена и/или PR – рецептор прогестерона более чем в 1% клеток) и нуждаются на определенном этапе в эндокринотерапии, способствующей снижению частоты рецидивов и смертности от РМЖ [1].
Пролиферация и выживание как нормальной, так и раковой ткани молочной железы при этом происходит благодаря эстроген-индуцированной активации ядерных рецепторов ERα и ERβ. Рецептор эстрогена (ER) впервые был обнаружен в 1958 г. Е.В. Дженсеном. Последующие исследования показали, что эстроген (E2) вовлечен в патогенез РМЖ и способствует росту экспрессирующих ER клеток РМЖ.
ER при связывании с эстрогеном димеризуется и транслоцируется в ядро, где ER-димеры связывают коактиваторы с образованием транскрипционно активного ER-комплекса. Связанный с эстрогеном ER индуцирует прогрессирование клеточного цикла, в т.ч. за счет индукции экспрессии MYC и CCND1 (циклин D1) [2]. Стимулированный эстрогеном ER также усиливает митогенную передачу сигналов, регулируя транскрипцию нескольких факторов роста, важных для развития молочной железы, включая трансформирующий фактор роста α (TGFa), инсулиноподобный фактор роста 1 (IGF-1), амфирегулин и эпидермальный фактор роста (EGF) [3]. Супрессия эстрогена и антагонисты ER остаются основой лечения ER+-РМЖ в течение нескольких десятилетий. В качестве эндокринотерапии ЕR+-РМЖ одобрены селективные модуляторы ER (SERM), селективные ER-регуляторы (SERD) и ингибиторы ароматазы [4], а также ингибиторы циклинзависимых киназ 4 и 6 (CDK4/6) в сочетании с ингибиторами ароматазы или с SERD.
SERMs – это класс лекарств, действующих непосредственно на рецептор эстрогена, обладающих частичным агонистическим и антагонистическим потенциалом. Самым известным представителем данной группы считается тамоксифен. Этот препарат в течение последних четырех десятилетий повсеместно использовался в качестве препарата выбора пациентов с РМЖ. Впервые препарат был применен в качестве лечения метастатического заболевания; позже его использование было исследовано и в лечении раннего РМЖ, что привело к относительному снижению частоты рецидивов на 40–50% [5].
Механизм действия ингибиторов ароматазы заключается в снижении уровня эстрогена путем блокирования перехода андрогенов в эстрогены у женщин в менопаузе. Также ингибиторы ароматазы в комбинации с агонистами гонадотропин-рилизинг-гормона используются в эндокринотерапии пременопаузальных женщин группы высокого риска [6–8].
Предполагается, что SERD (например, фулвестрант) действуют главным образом путем индукции деградации белка ER или блокирования транскрипционной активности ER [9, 10]. Тем не менее недавнее исследование показывает, что фулвестрант и подобные антагонисты ER подавляют активность ER главным образом за счет нарушения внутриядерной подвижности ER [11].
С более широким применением эндокринотерапии возник феномен эндокринорезистентности. Так, почти у 20% пациентов с ранним ER+-РМЖ возникает рецидив заболевания [12]. Эндокринорезистентность неизбежно возникает при ER+метастатическом РМЖ (мРМЖ, рис. 1).
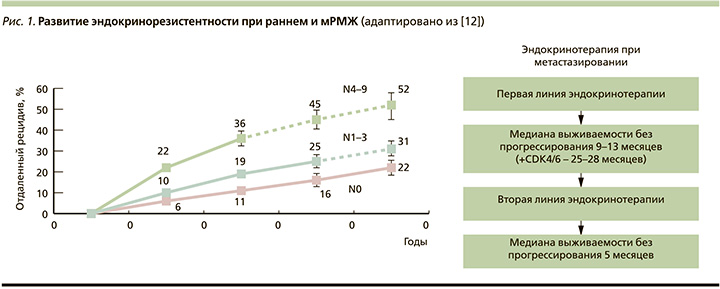
Согласно руководствам ESMO (European Society for Medical Oncology) и ASCO (American Society of Clinical Oncology), первичная эндокринорезистентность определяется как рецидив в течение первых 2 лет адъювантной гормонотерапии или прогрессирование заболевания в течение первых 6 месяцев гормонотерапии первой линии мРМЖ. Вторичная же эндокринорезистентность представляет собой рецидив после двух лет адъювантной гормонотерапии или в течение года после завершения адъювантного лечения, а также прогрессирование заболевания более чем через 6 месяцев после начала гормонотерапии при мРМЖ [13].
Первичная (врожденная) резистентность затрагивает меньше пациентов. У значительного же числа женщин развивается вторичная резистентность в ответ на эндокринотерапию. Изучается множество механизмов эндокринорезистентности, включая соматические альтерации, эпигенетические изменения и изменения в микроокружении опухоли.
Соматические изменения
1. Изменения в ER и ароматазе
Для многих методов лечения рака мутации в самой мишени, на которую направлено лекарственное средство, часто служат основным механизмом, посредством которого опухоль избегает ингибирования. ER является ядерным рецептором и состоит из двух подтипов: ERα и ERβ. ERβ оказывает противоположное действие по отношению к ERα и ингибирует стимулирующее действие E2 на пр...












