Эпидемиология и Инфекционные болезни. Актуальные вопросы №1 / 2016
Эпоха дженериков: за и против
1Научный центр экспертизы средств медицинского применения Минздрава России, Москва; 2Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России; 3Воронежская государственная медицинская академия им. Н.Н. Бурденко
Каждый год на фармацевтическом рынке появляются новые дженерики. Они необходимы для обеспечения доступной медицинской помощи. В мировой практике есть разные стандарты определения их терапевтической эквивалентности (взаимозаменяемости). Некоторые препараты требуют особо тщательной экспертизы биоэквивалентности. Вспомогательные вещества в составе этих препаратов играют ключевую роль в их эффективности и безопасности. Многим разработчикам дженериков не удается адекватно воспроизвести оригинальные препараты даже при идентичном составе. С учетом вступления в силу новых правил определения биоэквивалентности в России практикующему врачу полезно понимать основные принципы производства оригинальных и воспроизведенных лекарственных препаратов.
В России за последние 20 лет количество дженериков росло лавинообразно, и в 2013 г. их доля на рынке составляла 77%. Это часть общемирового процесса: по мере того как истекают патенты на оригинальные лекарства, появляется все больше дженериков. Несмотря на очевидные экономические преимущества воспроизведенных лекарств, они часто отличаются от оригинального препарата по профилю эффективности и безопасности. Чтобы понять, не принесет ли дженерик больше вреда, чем пользы, необходимо исследовать его биоэквивалентность. В мировой практике нет единого стандарта экспертизы биоэквивалентности [1]. Каждая страна решает этот вопрос, исходя из особенностей своих законов. Очень часто возникают юридические разночтения. В частности, многие страны по-разному толкуют понятие «дженерик», и поэтому Всемирная организация здравоохранения (ВОЗ) рекомендует использовать термин «мультиисточниковые лекарственные препараты» (англ. multi-source pharmaceutical products) [2]. Это фармацевтически эквивалентные или фармацевтически альтернативные препараты, которые могут быть или не быть терапевтически эквивалентными.
Эта формулировка допускает широкое толкование. Препараты могут быть признаны фармацевтическими эквивалентами, если они содержат одинаковую фармацевтическую субстанцию в той же лекарственной форме, с тем же путем введения и совпадают по дозировке или концентрации. При этом они могут различаться по форме, конфигурации риски, механизму высвобождения, сроку годности и вспомогательным веществам. Следовательно, если свойства препарата зависят от вспомогательных веществ, то у дженерика они будут другими, даже если он признан фармацевтическим эквивалентом.
В США приняты более строгие правила. В Оранжевой книге (Orange Book), основном справочнике по биоэквивалентности, специально сказано, что «лекарственные продукты считаются терапевтическими эквивалентами, только если они являются фармацевтическими эквивалентами, а также если от них ожидается тот же клинический эффект и профиль безопасности…». Следовательно, согласно требованиям Управления по контролю за пищевыми продуктами и лекарственными препаратами США (Food and Drug Administration – FDA), дженерик может заменить оригинальный препарат, только если он признан терапевтически эквивалентным [3].
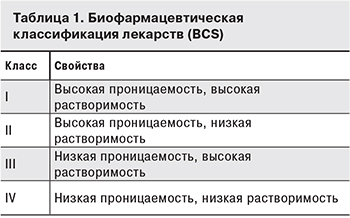 Представления о терапевтической и биоэквивалентности
Представления о терапевтической и биоэквивалентности
Биоэквивалентность не означает автоматически терапевтической эквивалентности, точно так же, как успехи препарата в лаборатории не всегда переходят в клиническую практику. Под биоэквивалентными лекарственными препаратами понимаются фармацевтически эквивалентные или фармацевтически альтернативные препараты, которые показывают сопоставимую биодоступность. Есть несколько подходов к определению биоэквивалентности. Например, 2 препарата будут биоэквивалентны, если исследуемый препарат по скорости и степени абсорбции несущественно отличается от скорости и степени абсорбции референтного препарата при однократном или многократном их применении в одинаковой молярной дозе фармацевтической субстанции в аналогичных экспериментальных условиях.
Биоэквивалентность – это одно из требований для терапевтической эквивалентности (взаимозаменяемости). Согласно подходам FDA и Европейского агентства по лекарственным средствам (EMA), 2 препарата могут быть признаны терапевтическими эквивалентами, если:
1. Они являются фармацевтическими эквивалентами в силу:
- идентичного содержания одинаковой фармацевтической субстанции в одинаковой лекарственной форме при одинаковом пути введения и
- соответствия фармакопейным или иным действующим стандартам по дозировке, качеству, чистоте и подлинности.
2. Они являются биоэквивалентными, то есть:
- в отношении них отсутствуют известные или потенциальные причины небиоэквивалентности (например, водные растворы для внутривенного введения заведомо признаются биоэквивалентными), и они удовлетворяют приемлемым стандартам in vitro (биовейвер) или
- при наличии таких известных или потенциальных причин они удовлетворяют надлежащим стандартам биоэквивалентности (то есть проведены исследования биэквивалентности).
3. Подтверждены их безопасность и эффективность.
4. Они сопровождаются правильной (обоснованной) информацией о лекарственном препарате в его инструкции по применению.
5. Они производятся в соответствии с текущими правилами надлежащей производственной практики.
Этот перечень устанавливает строгие требования, потому что, пропустив на рынок дженерики низкого качества, государство рискует понести большие расходы из-за последствий неэффективного лечения.
В России, согласно Федеральному закону от 22.12.2014 № 429-ФЗ «О внесении изменений в Федеральный закон „Об обращении лекарственных средств”» [4], в статье 27.1 утвержден порядок определения взаимозаменяемости лекарственных препаратов для медицинского применения. Взаимозаменяемость лекарственных препаратов определяется на основе следующих параметров:
- эквивалентност...












