Фарматека №9/10 / 2023
Ингибиторы кардиального миозина в лечении гипертрофической кардиомиопатии (обзор литературы)
Донецкий государственный медицинский университет им. М. Горького, Донецк, Россия
В обзоре представлена информация о современных препаратах – ингибиторах кардиального миозина (ИКМ), применяемых в лечении гипертрофической кардиомиопатии (ГКМП) и воздействующих на гиперконтрактильность миокарда, наблюдаемую при этом заболевании. Приведено современное понимание структуры и функции саркомера с позиции анализа основных структурных и функциональных белков, чьи нарушения лежат в основе патологии. Обсуждаются генетические изменения и основные патогенетические механизмы, приводящие к развитию ГКМП. Представлены сведения о многочисленных генных мутациях белков саркомера и обусловленных ими патогенетических событиях, приводящих в свою очередь к состоянию гиперконтрактильности миокарда, развитию патологической релаксации и повышенному потреблению энергии. Описываются механизмы действия ИКМ (мавакамтена и афикамтена) – фармакокинетика, фармакодинамика, способы применения и дозирования, особенности назначения у разных категорий больных. В обзоре изложены результаты проведенных в последние годы рандомизированных клинических исследований по оценке эффективности, безопасности и переносимости перечисленных препаратов. Приводится анализ данных исследований PIONEER-HCM, MAVERICK-HCM, EXPLORER-HCM, VALOR-HCM и REDWOOD-HCM, посвященных изучению эффективности и безопасности мавакамтена и афикамтена для больных ГКМП. Отмечены положительное влияние ИКМ на выраженность обструкции выносящего тракта левого желудочка (ЛЖ), улучшение функционального класса сердечной недостаточности, самочувствия больных. Описывается переносимость препаратов, влияние на систолическую функцию ЛЖ, оцениваемую по значениям фракции выброса. Результаты проведенных клинических исследований показали, что ИКМ оказывают существенное влияние на уменьшение выраженности обструкции выносящего тракта ЛЖ, замедление прогрессирования сердечной недостаточности и улучшение качества жизни больных. Несмотря на отмеченные достоинства, необходимо продолжение дальнейших исследований по оценке безопасности ИКМ, изучению их эффективности вне основной терапии ГКМП и среди различных групп больных. Мавакамтен и афикамтен дополняют имеющийся арсенал лечебных подходов к ведению пациентов с ГКМП.
Введение
Гипертрофическая кардиомиопатия (ГКМП) является генетическим заболеванием миокарда с распространенностью 1 случай на 200–500 человек [1–3]. При этом заболевании идентифицировано множество патогенных мутаций генов, кодирующих различные белки саркомера [4, 5]. Наряду с генетической гетерогенностью у пациентов с ГКМП отмечается разнообразие клинических проявлений, фенотипов гипертрофии миокарда, течения и исходов заболевания [5, 6].
В последние десятилетия в лечении ГКМП применяются различные фармакологические препараты и нефармакологические подходы, включая методы септальной редукции (МСР), имплантацию кардиовертеров-дефибрилляторов и трансплантацию сердца [3, 5]. Несмотря на успехи в лечении, ГКМП является прогрессирующим заболеванием, при котором развитие фибрилляции предсердий и сердечной недостаточности (СН) наблюдается у каждого 5-го больного в возрасте 50–70 лет [7].
Согласно российским рекомендациям по ГКМП [1], при лечении больных обструктивной формой заболевания с наличием симптомов, ухудшающих повседневную активность и качество жизни, рекомендуется назначение β-адреноблокаторов (БАБ) и негидропиридиновых блокаторов кальциевых каналов (БКК). По рекомендациям Европейского общества кардиологов по лечению кардиомиопатий 2023 г. и Американской ассоциации сердца/Американской коллегии кардиологов по диагностике и лечению больных ГКМП в случаях, рефрактерных к терапии с помощью БАБ и БКК, можно назначать дизопирамид [3, 8–10].
Пациентам с наличием выраженных симптомов, обусловленных обструкцией выносящего тракта (ВТ) левого желудочка (ЛЖ; градиент >50 мм рт.ст.), несмотря на применение максимально переносимых доз лекарственной терапии, показано лечение с помощью МСР, к которым относятся хирургическая миоэктомия и алкогольная септальная аблация [11, 12].
Последние годы ознаменовались открытием нового поколения болезнь-модифицирующих препаратов, воздействующих на миокардиальную гиперконтрактильность и нарушения энергетического баланса благодаря аллостерическому ингибированию миозина – основного белка, генерирующего силу сердечной мышцы [13, 14]. Настоящий обзор посвящен обсуждению новой группы фармакологических препаратов в лечении ГКМП – ингибиторов кардиального миозина (ИКМ).
Структура и сокращение саркомера
Саркомер представляет собой основную сократительную единицу поперечно-полосатой мускулатуры, состоящую из толстых и тонких филаментов. Основные сократительные белки саркомера представлены миозином толстого и актином тонкого филамента [15, 16]. Тонкие филаменты состоят из нитей α-актина и кальций-чувствительного тропонин-тропомиозинового аппарата, который включает тропонин T, тропонин I, тропонин C и α-тропомиозин (рис. 1) [17, 18]. Тонкие филаменты соединены с Z-линиями на обоих концах саркомера. Саркомер ограничен с обеих сторон Z-линиями, которые вместе с тонкими филаментами создают своего рода клетку вокруг толстой нити миозина, проходящей от центра саркомера наружу по направлению к Z-линии, не достигая ее [19].
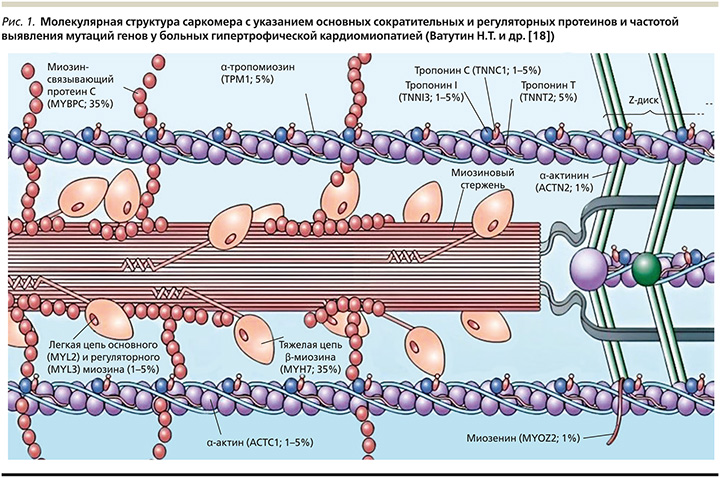
Толстые филаменты саркомера состоят из белков, обеспечивающих как моторные, так и регуляторные функции. Тяжелая цепь β-миозина (β-MHC – β-myosin heavy chain) содержит структурные и функциональные домены. Спиральные хвостики миозина собираются вместе, образуя цилиндрическую основу из толстых нитей, от которой через равные промежутки времени по спирали отходят пары миозиновых головок.
Головка миозина содержит нуклеотид-связывающий «карман» с активностью гидролазы АТФ, сайты связывания с актином и регуляторные домены, представленные регуляторной и основной легкими цепями [15, 20].
Цикл сокращения саркомера инициируется катионом кальция (Ca2+), который связывается с тропонином С для уменьшения ингибирующего влияния на тропониновый комплекс [19]. После связывания Ca2+ с тропонином C актин взаимодействует с головкой миозина. Сложное взаимодействие тропонина С с тропонинами I и T приводит тропомиозин в состояние «открытия» актинового участка, к которому может прикрепляться головка миозина. Во время сокращения головки миозина захватывают актин и тянут актиновые нити к центру саркомера. Таким образом, тонкие и толстые нити скользят друг против друга, сокращая саркомер и длину клетки [19].
Генетические изменения и патогенез ГКМП
В настоящее время идентифицировано более 2100 мутаций в 12 основных генах, кодирующих сократительные белки миофиламентов сердечного саркомера и Z-полосы [4, 21, 22]. Наиболее распространенными являются мутации генов β-миозина тяжелой цепи (MHY7) и миозин-связывающего протеина-С (MYBPC3), вместе составляющие 60–70% патогенных вариантов [20–22].
Любая мутация генов может изменять основные функции белков саркомера, включая сокращение, выработку энергии и утилизацию АТФ [23]. У пациентов с ГКМП отмечается неэффективность функции саркомера с повышенной чувствительностью миофиламентов к Са2+ и на...












