Клиническая Нефрология №4 / 2014
Клиническое значение определения матриксных металлопротеиназ и их ингибиторов у детей с синдромом Альпорта
1 Научно-исследовательский клинический институт педиатрии ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» МЗ РФ, Москва 2 ГБУЗ «ДГКБ им. З.А. Башляевой» ДЗМ, Москва
Цель. Установить роль матриксных металлопротеиназ и их нгибиторов в прогрессировании синдрома Альпорта (СА) у детей для разработки алгоритма прогнозирования течения заболевания.
Материал и методы. Тридцати двум детям с СА проведено определение в крови и моче основных компонентов системы протеолиза – матриксных металлопротеианаз (ММП-1, -2, -3, -9, -10), тканевых ингибиторов матриксных металлопротеиназ (ТИМП-1 и Т-2) и ингибитора активатора плазминогена I типа (ПАИ-I). Контрольную группу составили 10 детей, не имевших патологии почек.
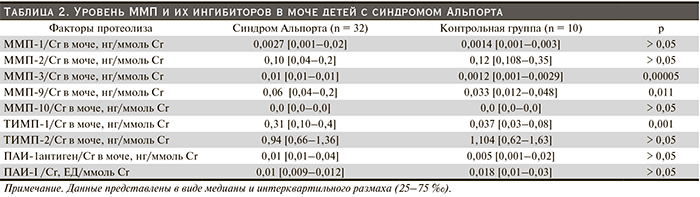
Результаты и обсуждение. У детей с СА уровни ММП-2, -3, ингибиторов ТИМП-2, ПАИ-I (антиген) в крови и уровни ММП-3/Cr, ММП-9/Cr и ТИМП-1/Cr в моче были достоверно выше по сравнению с контрольной группой. Уровень ТИМП-1/Cr мочи у детей с более выраженной суточной протеинурией (> 30 мг/кг/сут) достоверно выше и прямо коррелирует с суточной потерей белка детьми независимо от прогрессирования. У детей с прогрессирующим течением СА выявлены прямые корреляционные взаимосвязи с суточной протеинурией и ММП-2/Cr и ТИМП-1/Cr в моче, между креатинином крови и ММП-1 в крови, ММП-10 в крови, а в группе с непрогрессирующим СА – обратные между ММП-2/Cr в моче и суточной протеинурией и скоростью клубочковой фильтрации.
Заключение. Таким образом, выявленные взаимосвязи ММП и их ингибиторов с клиническими признаками СА у детей предполагают важную роль ММП и их ингибиторов в механизмах прогрессирования заболевания и обосновывают возможность их использования в качестве критериев прогрессирования СА.
Синдром Альпорта (СА) – генетически детерминированная гломерулопатия, в основе которой лежит мутация генов, кодирующих α3-, α4-, α5-цепи коллагена IV типа (COLIV). Заболевание проявляется гематурией, протеинурией, прогрессирующим снижением почечных функций, нередко сочетается с патологией слуха и зрения [1].
Распространенность СА составляет 1 случай на 5000 населения. С ним связано около 3 % случаев хронической почечной недостаточности у детей; пациентам с данным синдромом проводится 2,3 % почечных трансплантаций. Наиболее распространенным типом наследования является сцепленное с Х-хромосомой [2].
В настоящее время классификация СА проводится по типу наследования генетического дефекта: различают Х-сцепленную (№ 301050 по OMIM 1), аутосомно-рецессивную (№ 203780) и аутосомно-доминантную формы (№ 104200) [1].
Как известно, прогрессирование фиброза в паренхиме почек, ведущее к почечной недостаточности, является характерной чертой хронической болезни почек (ХБП) любой природы [3–6], который определяется развитием гломерулосклероза и тубулоинтерстициального фиброза. Фиброз, связанный с ХБП, имеет ряд общих характеристик, включая стойкую инфильтрацию воспалительными клетками, увеличение количества клеток интерстиция, атрофию и апоптоз эпителиальных клеток канальцев, облитерацию перитубулярных капилляров и накопление экстрацеллюлярного матрикса (ЭЦМ) [7], в результате дисбаланса между процессами его синтеза и протеолиза.
Матриксные металлопротеиназы (ММП) играют ключевую роль в процессах протеолиза в почах, в частности в расщеплении компонентов ЭЦМ, деградации базальных мембран и ряда клеточных поверхностных белков. Протеолитическая активность ММП зависит от взаимодействия факторов, способствующих активации латентных про-ММП (плазмин, система урокиназа/рецептор урокиназы), и факторов, ингибирующих эти процессы. Среди последних особое значение принадлежит тканевым ингибиторам ММП (ТИМП) и ингибитору активатора плазминогена I типа (ПАИ-I) [8, 9].

MMП представляют собой семейство структурно-связанных протеолитических ферментов, содержащих ион Zn2+ в активном центре. ММП секретируются разными клетками (фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы, хондроциты, остеобласты и др.) и гидролизируют все компоненты экстрацеллюлярного матрикса: все коллагены и проколлагены, протеогликаны, эластин, фибронектин, ламинин, а также адгезивные и другие белки соединительной ткани [8, 10, 11].
ММП играют важную роль во многих физиологических процессах, таких как эмбриональное развитие, морфогенез, репродукция и ремоделирование ткани, а также в различных патологических процессах. Изменение активности ММП (как увеличение, так и снижение) сопутствует многим заболеваниям человека (опухоли, фиброзирующие заболевания сердца, легких, печени и почек, артрит, язвенная болезнь желудка и т.д.).
Нарушение баланса в системе ММП и их ингибиторов служит одним из механизмов развития ряда острых и хронических заболеваний почек, поскольку в физиологических условиях в почке функционирует сбалансированная система ММП/ТИМП [12, 13].
В экспериментальных исследованиях показано значение ММП и их ингибиторов в прогрессировании СА. В частности, в эксперименте на собаках с СА, страдавших протеинурией и быстропрогрессирующей хронической почечной недостаточностью, в криосрезах почек выявлена повышенная активность ММП-2, -9 и -14, что отражало степень прогрессирования заболевания. Повышенная экспрессия ММП-2, -9 и -14 наблюдалась в корковом веществе склерозированных почек собак с Х-сцепленным СА. Эти результаты показывают, что ММП может играть важную роль в деградации ЭЦМ, связанного с прогрессирующим почечным фиброзом у этих животных [14]. Дальнейшие исследования в этом направлении показали, что у собак с СА, в отличие от здоровых животных, кроме ММП-2 и -9 повышена экспрессия ММП-3 и -7 [15].
У крыс с индуцированным СА выявлено повышение ММП-1, -3 и -9 при прогрессировании почечной дисфункции. Использование синтетических ингибиторов ММП у крыс с генетически подтвержденным СА до появления протеинурии замедляло прогр...












