Терапия №9 / 2021
Клиническое значение полиморфизмов генов в развитии метаболического синдрома у молодого населения
1) БУ ХМАО–Югра «Сургутский государственный университет»;
2) ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины», г. Новосибирск;
3) Научно-исследовательский институт терапии и профилактической медицины – филиал ФГБНУ «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук», г. Новосибирск
Аннотация. Широкая распространенность в странах с высоким уровнем жизни высококалорийного питания в сочетании со снижением расхода мышечной энергии ведет к формированию в генетической памяти механизма инсулинорезистентности и развитию метаболического синдрома (МС).
Цель – изучить влияние полиморфизмов генов на развитие метаболических нарушений среди молодых жителей Севера.
Материал и методы. Проведено проспективное когортное исследование 883 молодых людей, длительно проживающих в условиях, приравненных к Крайнему Северу (средняя длительность проживания – 27,9±0,005 лет), за период 2015–2020 гг.: 749 пациентов с МС и 134 без проявлений МС. В рамках выполненного молекулярно-генетического исследования были изучены следующие полиморфизмы генов: rs1378942 гена CSK, rs1801133 (С677Т) гена MTHFR, гена ITGA2B, rs7903146 гена TCF7L2, rs1799752 гена АСЕ. Геномную ДНК выделяли из венозной крови методом фенол-хлороформной экстракции. Полиморфизм генов тестировали с помощью полимеразной цепной реакции с полиморфизмом длин рестрикционных фрагментов.
Результаты. При оценке антропометрических данных, результатов лабораторных анализов у пациентов с МС выявлены гипергликемия в 31,8%, гиперинсулинемия – в 13,8%, гипохолестеринемия ЛВП – в 19,4%, гипертриглицеридемия – в 78,1%, артериальная гипертензия – в 14,1% случаях. В общей выборке обследованных лиц среди изучаемых полиморфных локусов чаще встречались локусы генов АСЕ и CSK. При анализе распределения пар генотипов среди обследованных пациентов с МС в общей когорте наиболее были распространены сочетания полиморфизма гена ITGA2B и полиморфного локуса rs1378942 гена CSK (18,0%). При этом чаще данные взаимодействия встречались среди коренных (18,9%) и некоренных сельских (18,6%) жителей Севера. При сочетании компонентов МС наиболее часто выявлялись полиморфизмы генов, включающих гетерозиготные генотипы ID гена ACE, ITGA2B, гомозиготные генотипы СС генов TCF7L2 и MTHFR, гетерозиготный генотип GT гена CSK.
Заключение. Клинические проявления МС у обследованных некоренных и коренных молодых жителей Севера обусловлены сложными межгенными взаимодействиями изученных нами однонуклеотидных полиморфизмов пяти генов: ACE, TCF7L2, ITGA2B, CSK, MTHFR. Чаще встречались сочетания мутантных полиморфизмов генов – гетерозиготные генотипы ID гена ACE, ITGA2B, гомозиготные генотипы СС генов TCF7L2 и MTHFR, гетерозиготный генотип GT гена CSK. Среди них преимущественную роль в развитии МС занимает ген CSK. Раннее выявление генетических предикторов метаболических нарушений имеет важное клиническое значение с целью своевременной профилактики развития сердечно-сосудистых заболеваний и сахарного диабета.
ВВЕДЕНИЕ
Эпидемия ожирения, в патогенетической основе которого лежит инсулинорезистентность (ИР), является серьезной социально-экономической проблемой. Для решения этой проблемы важны ранняя диагностика, профилактика и лечение составляющих метаболического синдрома (МС): ожирения, дислипидемии, артериальной гипертензии (АГ) и сахарного диабета (СД) 2-го типа. В странах с высоким уровнем жизни население перешло к высококалорийному питанию в сочетании со снижением расхода мышечной энергии, результатом чего стало формирование в генетической памяти механизма ИР и развитие МС.
В настоящее время человек постоянно сталкивается с воздействием новых факторов среды, ранее никогда не встречавшихся на протяжении всей его эволюции, а также испытывает большие «нагрузки» социального и экологического характера [1]. Увеличение мутагенной «нагрузки», миграции населения привело к изменению генетической структуры популяций [1].
Цель исследования – изучить влияние полиморфизмов генов на развитие метаболических нарушений среди молодых жителей Севера.
МАТЕРИАЛ И МЕТОДЫ
Проведено проспективное когортное исследование на базе БУ ХМАО–Югра «Федоровская городская больница», филиала больницы в д. Русскинская, БУ ХМАО-Югра «Сургутская городская клиническая поликлиника № 1». Обследованы 883 молодых человека, длительно проживающих в условиях, приравненных к Крайнему Северу (средняя длительность проживания – 27,9±0,005 лет) за период 2015–2020 гг.: 749 с МС и 134 человека без проявлений. Дизайн исследования представлен в таблице 1.
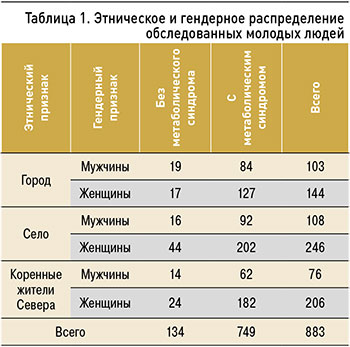
Критерием МС считалось наличие трех из пяти метаболических нарушений: абдоминального ожирения (АО) в виде повышенной окружности талии (ОТ) (в норме у женщин – 80 см, у мужчин – 94 см), АГ (уровень артериального давления >135 и 90 мм рт.ст.), гипертриглицеридемии (≥1,7 ммоль/л), снижения уровня липопротеидов высокой плотности (3,0 ммоль/л), гипергликемии натощак (уровень глюкозы плазмы натощак ≥6,1 ммоль/л) [2].
Молекулярно-генетическое исследование выполнялось в НИИ терапии и профилактической медицины – филиале Федерального исследовательского центра Института цитологии и генетики Сибирского отделения РАН. Геномную ДНК выделяли из венозной крови методом фенол-хлороформной экстракции. Полиморфизм генов тестировали с помощью полимеразной цепной реакции с полиморфизмом длин рестрикционных фрагментов (ПЦР с ПДРФ) [2]. Были изучены следующие полиморфизмы генов: rs1378942 гена CSK, rs1801133 (С677Т) гена MTHFR, гена ITGA2B, rs7903146 гена TCF7L2, rs1799752 гена АСЕ. Однонуклеотидный полиморфизм (SNP) rs1378942 гена CSK локализован на 15q24.1 хромосоме и кодирует изофермент цитохром P450-зависимой монооксигеназы, тирозинкиназы, играет роль в регуляции клеточного роста и дифференцировки нормальных клеток [2–4]. Функция фермента метилентетрагидрофолатредуктазы MTHFR (расположен на хромосоме 1p36.3) связана с нарушениями обмена гомоцистеина, обладающим атерогенным действием. Была изучена частота полиморфизма rs1801133 (С677Т) гена MTHFR [2, 5, 6]. Ген ITGA2B (локализован на хромосоме 17q21.32) – мембранный белок, димерный интегрин, состоящий из альфа цепи αIIb и бета цепи β3, экспрессируется на поверхности тромбоцитов, являясь рецептором фибриногена [2, 7, 8]. Полиморфизм rs7903146 гена TCF7L2 (хромосома 10q25.3) регулирует секрецию проглюкагона, влияющего на секрецию инсулина и на созревание бета-клеток поджелудочной железы из стволовых клеток [2, 9–11]. Регуляция кровяного давления и баланса электролитов, катализ расщепления ангиотензина I до активного ангиотензина II осуществляется с помощью ангиотензинпревращающего фермента (АПФ), который кодируется геном ACE, расположенным на хромосоме 17q23. Нами был изучена частота полиморфизма rs1799752 гена АСЕ [2, 12].
Полученные результаты были статистически обработаны с помощью пакета программ SPSS 16.0. На первом этапе определялись частоты генотипов и аллелей изучаемых полиморфизмов в группе пациентов с МС и в контрольной группе, затем оценивалось соответствие частот генотипов равновесию Харди–Вайнберга в контрольной группе (по критерию χ²). У обоих изучаемых полиморфизмах распределение частоты генотипов соответствовало равновесию Харди–Вайнберга. Относительный риск МС по конкретному аллелю или генотипу вычислялся как отношение шансов (ОШ) с использованием точного двухстороннего критерия Фишера и критерия хи-квадрат по Пирсону. В качестве уровня значимости использовали p <0,05 [2].
У всех пациентов было получено информированное согласие на участие в исследование.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам антропометрических исс...












