Фарматека №13 (266) / 2013
Место препаратов с метаболической направленностью (Тримектал МВ) в лечении ишемических синдромов
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова», Москва Автор для связи: А.М. Шилов – д.м.н., проф., зав. кафедрой «Неотложные состояния в клинике внутренних болезней» ФППОВ, e-mail: alexmshilov@mail.ru
В статье обсуждаются механизмы кардиопротекции триметазидина и его аналога Тримектала МВ у больных с сердечно-сосудистыми заболеваниями. Особо выделяется роль препаратов с метаболической направленностью при лечении больных с различными формами ишемической болезни сердца – от стабильной стенокардии до острого коронарного синдрома, с вариантами вмешательства на коронарных сосудах (профилактика синдрома реперфузии). Представлена антиангинальная эффективность Тримектала МВ в комплексной терапии больных стабильной стенокардией III функционального класса.
Ишемическая болезнь сердца (ИБС) в течение многих десятилетий ХХ и начала XXI столетий занимает ведущее место в структуре летальности среди населения в ведущих экономически развитых странах. Смертность от болезней системы кровообращения в Российской Федерации, по данным медицинской статистики за 2010 г., составила 56,5 % от общей летальности; из них более половины приходится на ИБС как причины летального исхода. Частота встречаемости ИБС резко увеличивается с возрастом населения: в большинстве европейских стран распространенность ИБС составляет 20–40 тыс. на 1 млн населения. По данным ГНИЦ ПМ, в РФ около «…10 млн трудоспособного населения страдают ИБС, более трети из них имеют стабильную стенокардию». Все вышеперечисленное определяет актуальность дальнейшего изучения патофизиологических механизмов развития и лечения сосудистой патологии, лежащей в основе ишемических синдромов.
Современная кардиология – наука, занимающаяся фундаментальными исследованиями механизмов функционирования сердца как насоса в обеспечении органной перфузии в норме и патологии. Она использует в своем развитии достижения молекулярной кинетики биологических процессов на уровне клеточных и субклеточных структур, в частности, позволяющих моделировать в нашем сознании процессы сопряжения возбуждения–сокращения–расслабления миокарда и энергетику, их обеспечивающую.
В настоящее время невозможно решать практические вопросы: определение рациональных путей профилактики и методов эффективного лечения ишемических эпизодов, лежащих в основе патогенеза сердечно-сосудистых заболеваний (ССЗ), без четкого представления механизмов внутриклеточных энергетических процессов, обеспечивающих жизнедеятельность сократительных элементов сердца и сосудов.
Сердце млекопитающих, в т. ч. человека, – это не только насос, совершающий огромную механическую работу по перекачиванию крови адекватно метаболическим нуждам организма. Одновременно оно – «биологический реактор», в котором происходят «сгорание» энергетических субстратов в присутствии кислорода (окислительное фосфорилирование), трансформация выделяющейся энергии в высокоэнергоемкую химическую связь конечной фосфатной группы в молекуле аденозин трифосфата (АТФ). За сутки в сердце 40-летнего мужчины, имеющего массу тела 80 кг, образуется и используется более 30 кг АТФ. Адекватность процессов синтеза АТФ обеспечивается сопряженностью нескольких этапов: непрерывное поступление в клетки энергетических субстратов, бесперебойная доставка кислорода, эффективная «работа фабрики АТФ» (митохондрий через окислительное фосфорилирование) и транспортировка энергии криатинфосфатом к исполнительным внутриклеточным структурам (ионные насосы, рецепторы, сократительные элементы).
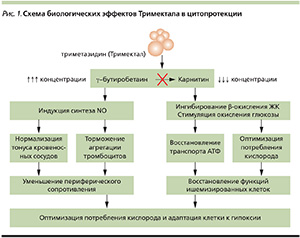 ИБС – результат несоответствия уровня потребления миокардом кислорода (основной компонент окислительного фосфорилирования углеводов, жиров, белков для образования АТФ) и объема его доставки коронарным кровотоком. Для энергообеспечения своей насосной деятельности от состояния покоя до максимальной нагрузки сердце утилизируeт различные субстраты: жирные кислоты, углеводы (глюкоза, гликоген, лактат), белки. В норме большая часть энергии АТФ миокард получает за счет β-окисления жирных кислот (ЖК) в митохондриях кардиомиоцитов.
ИБС – результат несоответствия уровня потребления миокардом кислорода (основной компонент окислительного фосфорилирования углеводов, жиров, белков для образования АТФ) и объема его доставки коронарным кровотоком. Для энергообеспечения своей насосной деятельности от состояния покоя до максимальной нагрузки сердце утилизируeт различные субстраты: жирные кислоты, углеводы (глюкоза, гликоген, лактат), белки. В норме большая часть энергии АТФ миокард получает за счет β-окисления жирных кислот (ЖК) в митохондриях кардиомиоцитов.
В физиологических условиях 10 % АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепление глюкозы и лактата до пирувата). Этого количества АТФ, образующегося в результате аэробного гликолиза, не хватает для обеспечения работы ионных кальциевых, натриевых и калиевых каналов сарколеммы, в частности кальциевого насоса саркоплазматического ретикулума. Восполнение остального количества энергии для функционирования кардиомиоцита при нормальной доставке кислорода происходит за счет окисления свободных жирных кислот (СЖК), метаболизм которых при окислительном фосфорилировании обеспечивает созидание до 80 % АТФ. Однако СЖК по сравнению с глюкозой – менее эффективный источник АТФ-«топлива» для сердца, т. к. при их окислении на выработку одного и того же количества АТФ требуется примерно на 10–12 % больше кислорода.
В условиях ишемии (снижение доставки О2) процесс образования АТФ нарушается с накоплением в митохондриях недоокисленных продуктов – ацилкарнитина, ацетилкоэнзима А (ацетил-КоА). Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних приводит к тому, что при ишемии (резкое падение доставки кислорода) в митохондриях кардиомиоцитов накапливается множество недоокисленных активных форм ЖК, что еще больше усугубляет разобщение окислительного фосфорилирования. Недоокисленные активные формы ЖК, в частности ацилкарнитин, ацетил-КоА, как метаболиты блокируют транспорт АТФ от места синтеза в митохондриях к месту их потребления внутри клетки. Кроме того, повышенная концентрация этих двух метаболитов в митохон...












