Урология №1 / 2019
Молекулярные основы внутриопухолевой гетерогенности уротелиальных карцином мочевыделительной системы
1) Кафедра патологической анатомии ГБОУ «Первый государственный медицинский университет им. И. М. Сеченова», Москва, Россия;
2) отделение патологической анатомии Научного клинического центра ОАО РЖД, Москва, Россия;
3) кафедра урологии ГБОУ «Первый государственный медицинский университет им. И. М. Сеченова», Москва, Россия
В статье представлены основные молекулярные механизмы патогенеза уротелиального рака мочевыделительной системы. Рассмотрено два молекулярных пути, определяющих развитие поверхностной и инвазивной уротелиальной карциномы, иммуногистохимический спектр стволовых маркеров и аспекты канцерогенеза множественных и рецидивных опухолей.
Уротелиальная карцинома (УК) – наиболее часто выявляемая гистологическая форма среди всех злокачественных опухолей мочевыделительной системы (МВС). Большинство (70–80%) УК МВС на момент диагностики поверхностное. К поверхностным формам рака принято относить неинвазивную папиллярную карциному (рТа), карциному in situ (рTis) и опухоли, характеризующиеся глубиной инфильтрации в пределах субэпителиальной соединительной ткани (рТ1). Остальные 20–30% новообразований характеризуются мышечно-инвазивным ростом уже на стадии выявления заболевания [1].
На сегодняшний день «золотым» стандартом диагностики УК органов МВС остается цистоскопия или уретероскопия с биопсией и последующим гистологическим исследованием материала [2, 3]. Известно, что определение риска развития и прогрессирования УК основывается на клинических и морфологических параметрах опухоли, таких как степень клеточной атипии, глубина инвазии, гистологический вариант опухоли, размер новообразования и мультифокальный характер роста. К недостаткам этого метода можно отнести следующие: 1) оценка степени клеточной анаплазии опухолевых клеток субъективна и осложнена малым объемом материала; 2) в биопсийном материале часто отсутствует мышечный слой, что не позволяет адекватно интерпретировать глубину инвазии опухоли; 3) в биопсийном материале может отсутствовать участок опухоли с наибольшей глубиной инвазии; 4) цистоскопическая картина часто не позволяет визуализировать наличие карциномы in situ. Из-за вышеперечисленных проблем частота ошибок в диагностике УК достигает 30–50% [4, 5].
 Прогресс в диагностике УК органов МВС произошел благодаря молекулярной биологии. Было установлено, что УК органов МВС, как и другие онкологические заболевания, имеет генетическую и эпигенетическую основу инициации и прогрессирования опухолевого процесса. Очевидно, что значительные различия в клиническом течении поверхностной и мышечно-инвазивной УК обусловлены различиями в генотипе опухолей.
Прогресс в диагностике УК органов МВС произошел благодаря молекулярной биологии. Было установлено, что УК органов МВС, как и другие онкологические заболевания, имеет генетическую и эпигенетическую основу инициации и прогрессирования опухолевого процесса. Очевидно, что значительные различия в клиническом течении поверхностной и мышечно-инвазивной УК обусловлены различиями в генотипе опухолей.
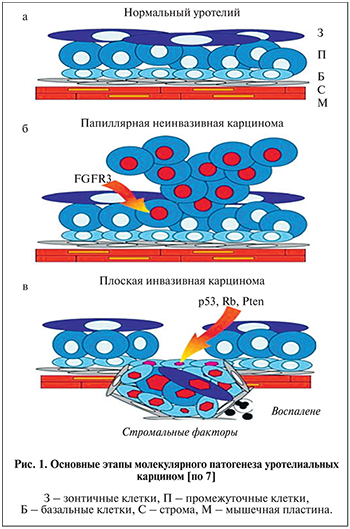
В настоящее время известны две области хромосомы 9, преимущественно теряющиеся при УК МВС, – 9р21 и 9q, что может рассматриваться как ключевое событие для развития опухоли [6]. Дальнейшие два независимых молекулярно-генетических пути развития рака определяются наличием мутации в генах FGFR3 и HRAS или инактивации пути p53/Rb/PTEN (рис. 1) [7–10].
Первый путь обусловлен мутациями в генах FGFR3 и HRAS, признанных основными молекулярно-генетическими маркерами поверхностного типа УК с исключением карциномы in situ. Механизм развития поверхностной УК заключается в гиперэкспрессии мутантного белка FGFR3, который, в свою очередь принимая участие в клеточной трансформации, усиливает экспрессию митогенактивированной протеинкиназы (МАРК). Похожий механизм реализуется и при стимуляции HRAS. При активизации каскадов МАРК происходит усиленная экспрессия транскрипционных факторов, что стимулирует клеточное деление, приводя к злокачественной трансформации [11–13]. В дополнение к непосредственной активации RAS-сигнального пути мутантный FGFR3 стимулирует фосфатидилинозитол-3-киназу (PI3K), активаторы сигнальной трансдукции и транскрипции. Активация сигнального пути «рецепторы тирозинкиназ–RAS–МАРК» играет одну из главных ролей в обновлении и пролиферации эпителиальных клеток посредством митогенного сигнала, который передается с клеточной поверхности к ядру. Следует отметить, что помимо FGFR3 в поверхностной УК гиперэкспрессируются и другие рецепторные тирозинкиназы, например рецептор EGFR и ERBB2 (HER2). Полученные результаты дают основание предполагать, что для развития поверхностной УК необходимо преимущественное повреждение системы протоонкогенов [14]. Второй путь характеризуется повреждением ТР53, RB1 и PTEN на фоне делеции генов-супрессоров опухолевого роста – р14(ARF), р15, р16, расположенных в области 9р21. В условиях нарушения регуляторных путей RB1-p16-cyclinD и ARFMDM2-р53 нарушается стабильность генома, в результате чего на фоне накопления молекулярно-генетических аберраций клетка приобретает антиапоптотический фено...












