Фарматека №7 / 2021
Оценка динамики иммунологических показателей в начале терапии в качестве прогностических и предиктивных факторов у больных меланомой
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия;
2) Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия
Введение
Иммунотерапия в настоящее время находит все новые показания к применению и служит компонентом терапии всех злокачественных опухолей благодаря регистрации агностических показаний к ее применению больными с микросателлитной нестабильностью [1]. Особенно актуальным в свете последних достижений становится поиск биомаркеров для определения прогноза и отбора пациентов, которым иммунотерапевтические стратегии действительно могут помочь. В то время как большинство исследователей сходятся во мнении о необходимости динамического контроля за иммунологическими маркерами, становится очевидным, что именно иммунологические показатели периферической крови могут быть удобным средством наблюдения и контроля за эффективностью терапии [2]. Однако иммунологический мониторинг до сих пор не входит ни в один из стандартов лечения злокачественных опухолей. Основной фокус внимания исследователей привлекают отдельные виды иммунных клеток, которые изучаются в качестве подобных маркеров. Мы же в своем исследовании АИСТ предприняли попытку оценить динамику основных субпопуляций лимфоцитов и оценить возможность ее использования в качестве раннего маркера ответа на терапию больных меланомой.
Цель исследования: оценка динамики основных субпопуляций лимфоцитов и возможность ее использования в качестве раннего маркера ответа на терапию больных меланомой.
Методы
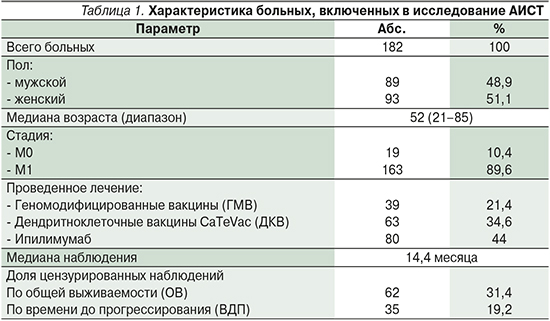
Для оценки роли динамики изменений иммунологических показателей в качестве предиктивных и прогностических факторов был проведен анализ ранних изменений в показателях иммунного статуса (ИС). С этой целью отобрали пациентов с меланомой, которым была проведена оценка ИС до лечения (в течение 4 недель до начала терапии) и в процессе лечения в течение первых 12 недель терапии. При этом для анализа при наличии нескольких ИС использовались в первую очередь оценки на 2–4-й неделях терапии, в их отсутствие последовательно включались ИС на 5–12-й и 1-й неделях лечения. Характеристика пациентов, включенных в исследование АИСТ, представлена в табл. 1.
Для оцени прогностической и предиктивной роли динамики иммунологических характеристик показатель на фоне лечения сравнивали с таковыми до лечения с использованием минимально определяемых различий (MDD), определение и расчет которых описаны в разработанном нами методе оценки [3]. Изменения показателя меньше MDD трактовались как отсутствие изменений. При больших различиях результат расценивался как повышение и понижение соответственно. Нами использованы два различных размера MDD: специфический, рассчитанный на каждого конкретного показателя, и общий, полученный на основании среднего значения сравниваемых показателей в соответствии с предложенной нами методикой. Во всех случаях сравнения пациенты с отсутствием изменений показателей расценивались как референсная категория. В отсутствие различий с референсной категорией к ней допускалось добавление больных с результатами из неотличавшейся категории для увеличения мощности исследования.
При оценке связи динамики с объективным ответом на лечение использовался ответ по RECIST 1.1. При этом оценивалась вероятность развития прогрессирования (ПЗ) или стабилизации (СЗ) заболевания, или объективного ответа (ОО) на лечение, включившего полный и частичный регресс.
В исследовании проведен анализ следующих субпопуляций иммунных клеток:
- показатели врожденной иммунной системы:
- лейкоциты, лимфоциты, моноциты, нейтрофилы, эозинофилы;
- NK-клетки (CD3-CD16+CD56+), NKТ-клетки (CD3+CD16+CD56+);
- нейтрофильно-лейкоцитарный индекс (NLR, отношение нейтрофилов к лимфоцитам), лимфоцитарно-моноцитарный индекс (LMR, отношение лимфоцитов к моноцитам), индекс NMLR (отношение суммы моноцитов и нейтрофилов к лимфоцитам);
- отношении NK- и NKT-клеток к ЦТЛ;
- показатели Т-клеточного звена адаптивной иммунной системы:
- Т-лимфоциты (CD3+CD19-), Т-хелперы (Th, CD3+CD4+), ЦТЛ (CD3+CD8+);
- активированные CD25+ и HL DR+ T-хелперы, активированные HL DR+ ЦТЛ;
- иммунорегуляторный индекс (ИРИ, отношение CD4+ к CD8+ лимфоцитам), отношение ЦТЛ к Treg;
- показатели В-клеточного звена адаптивной иммунной системы – В-лимфоциты (CD3-CD19+).
У больных, получавших вакцины, дополнительно оценивались общая экспрессия HLA DR и CD25 на мононуклеарах периферической крови, двойные негативные (CD3+CD4-CD8-) лимфоциты, функциональная активность лейкоцитов (спонтанная миграция и миграция, стимулированная КонА или ФГА), характеристики фагоцитоза (НСТ-тест, фагоцитарное число и фагоцитарный индекс нейтрофилов и моноцитов).
У больных, получавших ипилимумаб, дополнительно были оценены CD38+Th, CD38+ЦТЛ, CTLA4+Th, CD1D+ лимфоциты, CD3-CD16+56+NKG2D+, популяции клеток памяти (CD3+CD27+CD62L+, CD3+CD28+CD62L+, центральные Т-клетки памяти (СD3+СD45RA-СD62L+) и эффекторные Т-клетки памяти (СD3+СD45RA-СD62L).
Анализ связи изменений с ОО проводился с использованием метода хи-квадрат. В качестве меры значимости различи...












