Урология №4 / 2020
Оценка регенеративного потенциала плазмы, обогащенной тромбоцитами, при уретропластике в экспериментальной модели
1) Кафедра урологии и андрологии ФГАОУ ВО РНИМУ им. Н. И. Пирогова, Москва, Россия; 2) ГКБ № 1 им. Н. И. Пирогова, Москва, Россия; 3) ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России (Сеченовский Университет), Москва, Россия
Введение. Реконструктивно-пластические операции являются «золотым» стандартом лечения первичных стриктур уретры, но не обеспечивают 100%-ную эффективность. В случаях рецидивных стриктур уретры эффективность стандартных операций ниже, чем при первичных стриктурах, что требует поиска методов для улучшения результатов оперативного лечения.
Цель исследования: оценить изменения строения межклеточного матрикса, клеточного состава спонгиозного тела и регенеративный потенциал плазмы, обогащенной тромбоцитами, после выполнения уретропластики на биологической модели.
Материалы и методы. Эксперимент выполнен на 18 кроликах-самцах бургундской породы массой 3,0–4,5 кг. Было сформировано две группы по 9 животных: экспериментальная и контрольная. Всем животным была выполнена анастомотическая пластика бульбозного отдела уретры «конец в конец» по стандартной методике. В контрольной группе в спонгиозное тело в зону анастомоза вводили изотонический раствор 0,9% NaСl в объеме 4 мл, в основной группе – аутологичную плазму, обогащенную тромбоцитами. Гистологические препараты окрашивали гематоксилином и эозином для визуализации гистоархитектоники тканей, по Ван Гизону – для выявления коллагеновых волокон и оценки правильности их ориентации. С целью детализации воспалительных и регенеративных изменений проведено дополнительное иммуногистохимическое исследование с антителами к CD79a, CD43, CD31(PECAM1), MMP1, MMP9.
Результаты. Анализ гистологического материала показал, что локальное введение плазмы, обогащенной тромбоцитами, в область шва способствует уменьшению зоны некротических изменений и выраженности воспаления, ускоренной миграции в очаг альтерации клеток макрофагально-гистиоцитарного ряда и усилению кровоснабжения за счет усиленного ангиогенеза. Также в экспериментальных образцах отмечены более высокая экспрессия MMP1, MMP9, сниженная продукция коллагена, правильная ориентация коллагеновых волокон.
Заключение. Применение плазмы, обогащенной тромбоцитами, способствует ускорению репаративных процессов в спонгиозном теле после уретропластики. Другим немаловажным положительным эффектом плазмы, обогащенной тромбоцитами, является повышение экспрессии металлопротеиназ, что приводит к снижению продукции коллагена и правильной ориентации коллагеновых волокон. Этот позволяет снижать количество патологической фиброзно-рубцовой ткани в зоне операции.
Введение. Стриктура уретры – это заболевание, при котором отмечается сужение мочеиспускательного канала в результате метаплазии эпителия и формирования зоны спонгиофиброза [1]. В основе развития стриктур уретры лежат локальные рубцовые изменения, возникающие вследствие избыточной продукции коллагеновых волокон. Депозиты коллагена препятствуют пролиферации, дифференцировке и миграции клеток микроокружения в стромальном компоненте тканей, что в свою очередь может стать причиной прогрессирующей склеротической деформации уретры [2]. Улучшение результатов лечения требует не только усовершенствования оперативной техники уретропластики, но и поиска методов влияния на патогенетические звенья формирования стриктуры уретры. Одним из наиболее безопасных методов служит применение плазмы, обогащенной тромбоцитами (PRP). Обогащенная тромбоцитами плазма не только обладает регенеративным потенциалом, но и уменьшает воспалительный процесс, спонгиофиброз и отек ткани [3]. Факт снижения спонгиофиброза при применении PRP имеет фундаментальный интерес к лечению стриктур уретры, как первичных, так и рецидивных.
Цель исследования: оценить изменения строения межклеточного матрикса, клеточного состава спонгиозного тела и регенеративный потенциал PRP после выполнения уретропластики на биологической модели.
Материалы и методы. Эксперимент выполнен на 18 кроликах-самцах бургундской породы массой 3,0–4,5 кг. Перед экспериментом все животные были осмотрены ветеринарным врачом с целью выявления и исключения больных особей. Содержание животных и работа над ними проводились на базе вивария ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России. Во время проведения эксперимента соблюдались требования нормативных документов, регламентирующих проведение исследований с участием животных: Правилами проведения работ с использованием экспериментальных животных, утвержденными Приложением к приказу Министерства здравоохранения СССР от 12.08.1977, № 755; Европейской Конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18.03.1986).
Было сформировано две равнозначные группы животных: экспериментальная и контрольная.
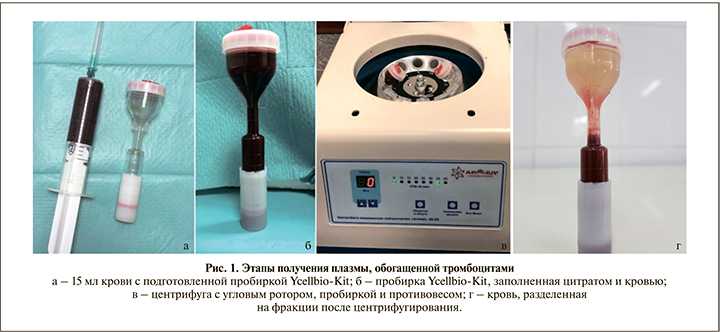
Методика получения плазмы, обогащенной тромбоцитами. В асептических условиях из ушной вены выполняли забор 15 мл крови в стерильный шприц 20 мл, содержащий 1,5 мл 3,2%-ного цитрата натрия (рис. 1, а). Кровь из шприца переливали в пробирки Ycellbio-Kit (рис. 1, б), затем кровь центрифугировали (аппарат Armed 80-2S с угловым ротором, Китай) при скорости 3500 об/мин в течение 4 мин (рис. 1, в), в результате происходило разделение крови на три фракции: плазму, PRP и эритроцитарную массу (рис. 1, г). Плазму, обогащенную тромбоцитами, набирали в 5-миллитровый одноразовый шприц. Объем PRP составлял в среднем 1,5–2 мл.
Методика уретропластики и введения плазмы. Поперечным разрезом в области промежности выполняли доступ до бульбозного отдела уретры. Циркулярно мобилизовали весь бульбозный отдел уретры в дистальном и проксимальном направлении (рис. 2, а). Ориентируясь на введенный в уретру катетер Фолея № 6, поперечно пересекали уретру (рис. 2, б). Накладывали 6 узловых швов (рис. 2, в) с анастомозированием краев уретры «конец в конец» (рис. 2, г). Затем устанавливали силиконовый уретральный катетер 8 Сh, ушивали бульбоспонгиозную мышцу и послойно ушивали рану. Кровопотеря составила около 5 мл.
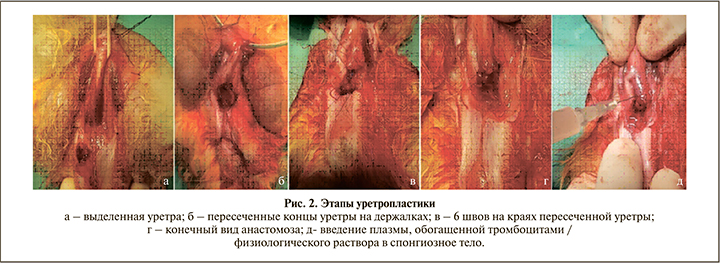
В экспериментальной группе проводили активацию аутологичной плазмы 10%-ным хлоридом кальция в соотношении 1:10. После активации в течение 10 мин выполнялось введение PRP в объеме 4 мл по периметру анастомоза (рис. 2, д). Животным контрольной группы аналогичным образом вводили изотонический раствор 0,9% NaСl.
Методика гистоморфологического исследования. Для исследования осуществляли забор образцов тканей уретры размером 1,0×0,5×0,5 см. Края резекции всех образцов были прошиты хирургической лигатурой. Забор материала осуществляли на 3-и, 7-е и 15-е сутки после оперативного вмешательства. На каждом сроке выполнялось выведение из эксперимента по три животных из контрольной и экспериментальной групп. Все образцы тканей фиксировали в растворе забуференного формалина с последующим изготовлением залитых парафином блоков и готовых микропрепаратов.
Рутинную окраску гематоксилином и эозином использовали для визуализации гистоархитектоники тканей. Также применяли окраску по Ван Гизону для выявления коллагеновых волокон и оценки правильности их ориентации (для визуализации матрикса и клеток используются три красителя: пикриновая кислота окрашивает цитоплазму клеток в желтый цвет; железный гематоксилин по Вейгерту придает ядрам черную окраску, а коллагеновые волокна окрашиваются кислым фуксином в красный цвет).
С целью объективной детализации в...












