Фарматека №4 / 2022
Оптимизация медикаментозного лечения акромегалии (клинико-морфологическое сопоставление)
1) Эндокринологический диспансер ДЗМ, Москва, Россия;
2) Референс-Центр патоморфологических, иммуногистохимических и радиологических методов исследований, Национальный медицинский исследовательский центр эндокринологии, Москва, Россия
Обоснование. С учетом морфологической гетерогенности соматотрофных опухолей в настоящее время особенно актуальны поиск и стратификация возможных предикторов, позволяющих прогнозировать клиническое течение заболевания и эффективность лечебного пособия.
Цель исследования: проведение клинико-морфологического сопоставления между эффективностью длительной медикаментозной терапии (МТ) аналогами соматостатина 1-го поколения (АС1) и иммунофенотипическими особенностями плотно и редко гранулированных соматотрофных аденом (ПГА и РГА), выявленных с использованием иммуногистохимического анализа (ИГА).
Методы. Были обследованы 65 больных акромегалией, перенесших транссфеноидальную аденомэктомию. У 28 (9 мужчин) была выявлена ПГА, у 37 (14 мужчин) - РГА. Больные ПГА отличались поздним возрастом диагноза и меньшими исходными размерами аденомы гипофиза. При ИГА в ПГА выявлялись больший процент клеток с антителами (АТ) к гормону роста (ГР), большая экспрессия 2-го подтипа соматостатиновых рецепторов (ССР), а также большие разница и соотношение между 2-м и 5-м подтипами ССР. У подавляющего числа больных ПГА наблюдалась хорошая чувствительность к вторичной МТ АС1 с достижением ранней и стойкой биохимической ремиссии. Выявлена корреляция между величиной снижения уровня инсулиноподобного фактора роста-1 (ИРФ-1) через 3 месяца лечения и экспрессией 2-го подтипа ССР. Напротив, больные РГА отличались ранним возрастом диагноза, большими размерами аденомы гипофиза с экстраселлярным распространением и инвазивным ростом. При ИГА в РГА отмечались низкая экспрессия 2-го и повышенная экспрессия 5-го подтипов ССР, высокий процент клеток с АТ к цитокератину, высокие показатели пролиферативного индекса Ki-67. Использование АС1 больными РГА проявлялось низкой величиной подавления уровня ИРФ-1 через 3, 6 и 12 месяцев лечения, а также отсутствием биохимической ремиссии при последнем визите.
Заключение. Результаты работы подтверждают наличие принципиальных клинико-морфологических различий между ПГА и РГА, а также необходимость дифференцированного подхода к лечению. Величина снижения уровня ИРФ-1 через 3 месяца лечения коррелирует с выраженностью экспрессии 2-го подтипа ССР и может быть использована в качестве отрезной точки для прогноза эффективности длительной первичной или вторичной терапии АС1.
Введение
Акромегалия (АМ) является гетерогенным заболеванием, объединяющим различные клинико-патоморфологические варианты гипофизарных и внегипофизарных нейроэндокринных опухолевых образований, отличающихся рецепторным фенотипом, пролиферативной активностью и чувствительностью к предъявляемому лечению. Согласно классификации опухолей эндокринных органов Всемирной организации здравоохранения (ВОЗ, 2017) среди соматотрофных опухолей гипофиза морфологически выделяют четыре подтипа: плотно гранулированные (ПГА), редко гранулированные (РГА) аденомы, маммосоматотрофные (опухоли состоят из одной популяции клеток, способных секретировать гормон роста [ГР] и пролактин [ПРЛ]) и смешанные соматолактотрофные (опухоли состоят из двух клеточных популяций, которые изолированно секретируют ГР или ПРЛ) аденомы. Несмотря на то что все эти морфологические подтипы дифференцируются из стволовых соматотрофных клеток и принадлежат одной ацидофильной линии, они различаются дополнительными факторами транскрипции, гистологическими, иммунофенотипическими характеристиками, а также особенностями клинического течения [1, 2].
Наиболее часто (в 30-50% случаев) встречаются ПГА, состоящие из «ярко» эозинофильных опухолевых клеток с диффузной положительной экспрессией ГР и перинуклеарным расположением низкомолекулярных цитокератинов. При электронном микроскопировании выявляется хорошо развитый эндоплазматический ретикулум, большой комплекс Гольджи, многочисленные перинуклеарные промежуточные нити и множественные крупные (300-600 нм) электронноплотные секреторные гранулы, содержащие ГР [10]. Иммуногистохимический анализ (ИГА) опухолевого материала с помощью специфических антител (АТ) выявляет высокую экспрессию 2-го и низкую экспрессию 5-го подтипов соматостатиновых рецепторов - ССР (рис. 1) Как и нормальные соматотрофы, опухолевые клетки способны экспрессировать а-субъединицу гликопротеиновых гормонов. Данный опухолевый вариант, как правило, выявляется у пациентов старше 50 лет и отличается медленным ростом, преимущественно интраселлярным расположением, а также хорошей чувствительностью к аналогам соматостатина 1-й генерации (АС1).
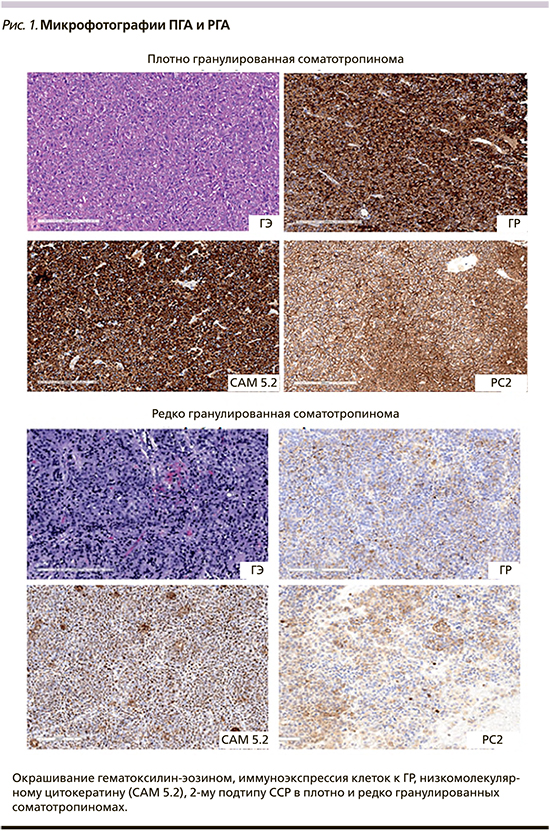
РГА, обнаруживаемые у 20-30% пациентов с АМ, состоят из слегка эозинофильных или хромофобных клеток. Электронная микроскопия демонстрирует большие скопления кератиновых нитей, а также наличие заметных юкстануклеарных кератиновых агрегатов, известных как «фиброзные тельца». Секреторные гранулы редкие, вследствие чего эти опухоли обладают слабой или очаговой иммуноэкспрессией ГР. При ИГА отмечается слабовыраженная и в меньшем количестве клеток соматотропином экспрессия 2-го и более выраженная экспрессия 5-го подтипов ССР (рис. 1). В отличие от ПГА этот вариант опухоли отличается повышенной пролиферативной активностью и высоким риском малигнизации. Индекс Ki-67 в большинстве случаев превышает 3%. РГА наблюдаются у пациентов с ранним дебютом заболевания, характеризуются большими размерами, активным экстраселлярным ростом, инвазивным распространением в окружающие ткани с развитием интраселлярной и интракраниальной компрессии. Несмотря на то что эти опухоли обладают относительно меньшей секреторной активностью по сравнению с ПГА, тем не менее их лечение представляет клиническую проблему, поскольку они проявляют склонность к послеоперационному продолженному росту и рецидивированию, зачастую резистентны к медикаментозному и/ или радиологическому лечению. Все эти характеристики дали основание включить РГА в особую группу опухолей «высокого риска».
Некоторые авторы описывают промежуточный вариант соматотрофных опухолей, клетки которых имеют высокую экспрессию 2-го подтипа ССР и присутствие фиброзных телец в небольшом количестве (менее 70% опухолевых клеток). Согласно классификации ВОЗ (2017), промежуточный вариант рекомендовано относить к категории ПГА, т.к. они обладают сходным клиническим течением и чувствительностью к АС1. Что же касается других морфологических подтипов соматотропином, то генетически детерминированные маммосоматотрофные аденомы, манифестирующие в раннем возрасте гипофизарным гигантизмом, являются заведомо устойчивыми к предъявляемому лечению, тогда как чувствительность к АС1 бицеллюлярных соматолактотрофных опухолей зависит от рецепторной экспрессии соматотрофного компонента [3—5].
Современный алгоритм медицинского пособия при АМ последовательно включает хирургическое лечение, медикаментозную, лучевую и цитостатическую терапию. При этом объем и характер лечебных мероприятий зависят от возраста пациента, его соматического статуса, величины масс-эффекта, радикальности проведенной аденомэктомии, секреторной и пролиферативной активности резидуальной опухолевой ткани, чувствительности к лекарственным препаратам.
Транссфеноидальная аденомэктомия, выполняемая квалифицированным нейрохирургом, является основным методом лечения большинства пациентов, поскольку является единственным средством, позволяющим достигать быстрого контроля заболевания. В зависимости от исходных размеров сомато...












