Акушерство и Гинекология №12 / 2014
Опыт применения препарата гинестрил в лечении больных с миомой матки
ФГБОУ ДПО Институт повышения квалификации ФМБА России; ГБУЗ Городская клиническая больница № 20, 11-й роддом Департамента здравоохранения г. Москвы; Медсанчасть № 170 ФМБА России; ГБУЗ Городская поликлиника № 109 Департамента здравоохранения г. Москвы, филиал № 2
В статье оценивается эффективность и переносимость длительной медикаментозной терапии миомы матки препаратом гинестрил. Из 86 больных, включенных в исследование, оценка эффективности и безопасности терапии проведена у 78. Клинический анализ эффективности терапии показал, что максимальное уменьшение размеров узлов лейомиомы достигнуто у 83,3% больных. В 92% наблюдений удалось достигнуть контроля симптомов болезни. Аменорея, восстановление гемоглобина и уменьшение боли отметили большинство больных. Побочные эффекты лечения наблюдались у 8% больных. При отсутствии эффекта от лечения или выраженных побочных проявлениях терапии больные были оперированы. Сделано заключение, что препарат гинестрил высокоэффективен, безопасен и перспективен для медикаментозного лечения больных миомой матки репродуктивного и пременопаузального возрастов.
Лейомиома матки, моноклональная, фиброзно-мезенхимальная доброкачественная опухоль, влияет на здоровье более 20% женщин репродуктивного возраста и затрагивает более 50% в пременопаузальном возрасте [1]. Болезнь длительно протекает практически бессимптомно и обнаруживается лишь при ультразвуковом исследовании органов малого таза, однако это одна из наиболее частых проблем женщин с жалобами на гиперполименорею и слабость, обращающихся за помощью к врачу [2]. По данным статистических отчетов США, лейомиома является основной причиной операций у 38,1% женщин в возрасте от 18 до 40 лет и у 67% – в возрасте старше 45 лет. Соотношение радикальных и органосохраняющих операций обычно составляет 6 к 1 [3].
Гетерогенность и неопределенность причин роста лейомиомы матки (аутокринные и паракринные факторы роста, генетические аномалии, расовые и экологические особенности) не позволяют предложить единое патогенетическое лечение больным [4, 5]. Это обусловливает отсутствие органосохраняющего метода со 100% положительным результатом, недоверие многих врачей к медикаментозной терапии, частые радикальные операции по удалению органа. Мультифокальность узлов не позволяет добиться удовлетворительных результатов лечения даже после миомэктомии или эмболизации артерий, оставляя в последующие 3 года 21,4% кумулятивного риска рецидива [6, 7]. Эффективность до 50–70% показали агонисты GnRH и даназол, однако их выраженный недостаток – гипоэстрогения, нежелательные побочные эффекты и частые рецидивы роста узлов ограничивают их широкое применение [8, 9]. Обобщенные молекулярные исследования механизма роста лейомиомы продемонстрировали, что в большинстве наблюдений «…поддержание пролиферации миометрия зависит от активации прогестероном своих рецепторов» в основном во вторую фазу менструального цикла, то есть при высоком уровне прогестерона [10]. Повышенную пролиферативную активность, гиперэкспрессию Ki67 в миометрии за счет геномных эффектов прогестерона в конце секреторной и лютеиновой фазе цикла подтверждают еще несколько последних работ [11–14]. Пролиферация зависит от уровня прогестерона и числа его рецепторов, изменения гормонов могут приводить к стимуляции ростовых факторов, воспалению, фибролизу, спазму артериол и изменению внеклеточного матрикса, что является субстратом для прогрессии роста узлов [15]. Поэтому действие антипрогестинов, блокирующих транскрипторные механизмы активации, имеет хороший таргентный эффект по остановке роста лейомиомы, что мы наблюдаем в клинике [16, 17]. Более 50 научных работ убедительно демонстрируют перспективу медикаментозной стабилизации роста миоматозных узлов небольших размеров с помощью самого изученного антипрогестина – мифепристона [18]. В качестве терапевтического средства для лечения миомы матки препарат был изучен в различных режимах: дозировки от 5 до 50 мг, длительность приема от 3 до 12 мес [19, 20]. Все режимы терапии показали хорошую переносимость лечения и безопасность (побочные эффекты не превышали 4%, включая незначительное повышение трансаминаз) [21, 22]. Ультразвуковая визуализация утолщенного и неоднородного эндометрия при длительном приеме мифепристона морфологически соответствовала кистозной, апоптотической (неактивной) дегенерации эндометрия, с его своеобразной атрофией, но без изменения стромы [23]. Антипрогестероновая активность мифепристона (RU 486) используется уже более 20 лет в различных клинических ситуациях, в том числе и в медикаментозном лечении лейомиомы, за счет его способности к десенситизации прогестероновых рецепторов, преобладающих в измененных миоцитах [24]. Клинические данные свидетельствуют об уменьшении размеров матки и миоматозных узлов от 26 до 74% объема, а также о высоком уровене контроля над симптомами болезни у 96% больных [25], что выводит препарат в первую линию терапии больных миомой матки, однако требует продолжения исследований по совершенствованию режимов.
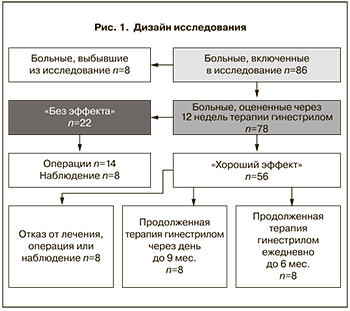 Материал и методы исследования
Материал и методы исследования
Исследование по изучению препарата гинестрил (мифепристон 50 мг) в ежедневном монорежиме (1 таб./сут) не менее 12 недель лечения было несравнительным и нерандромизированным (рис. 1). Терапия начиналась на 3-й день менструального цикла и при удовлетворительной переносимости...












