Терапия №2 / 2020
Основы фармакокинетики моноклональных антител
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
В работе представлено описание особенностей фармакокинетики моноклональных антител (МАТ). Будучи макромолекулами белковой природы, они имеют ряд характерных фармакокинетических особенностей.
При пероральном приеме МАТ абсорбируется не более 1–2% общей дозы препарата. Предпочтительными путями введения являются внутривенный, подкожный и реже внутримышечный. Время достижения максимальной концентрации при подкожном введении отсрочено и составляет от 2 до 14 дней.
Распределение МАТ может быть описано классической двухкамерной моделью с объемом центральной камеры 2–3 л и периферической камеры 8–20 л.
Выведение МАТ в основном осуществляется за счет мишень-ассоциированного механизма элиминации. В зависимости от препарата период полувыведения может составлять от 1 нед до 18–21 дней. Препараты этого ряда выводятся в первую очередь за счет внутриклеточной лизосомальной деградации до коротких пептидов и аминокислот.
На элиминацию МАТ могут влиять как иммунизация организма, так и общая масса специфических мишеней — в последнем случае по мере получения терапевтического ответа скорость элиминации может уменьшаться.
Для средних и больших терапевтических доз МАТ может быть характерна нелинейная кинетика, что связано с насыщением рецепторов, через которые опосредуется элиминация.
Моноклональные антитела (МАТ) представляют собой один из способов таргетного воздействия на патогенетические механизмы тех или иных заболеваний. Наибольшее распространение лечение препаратами этой группы получило в онкологии и онкогематологии, однако в последнее десятилетие схемы лечения с применением антител входят также в клинические рекомендации по лечению различных внутренних болезней. В первую очередь это ревматология, где, например, используются антитела к рецептору интерлейкина-6 (IL-6) тоцилизумаб и сарилумаб. Другие области применения этой группы лекарственных средств – бронхиальная астма (омализумаб – антитела к IgE), воспалительные заболевания кишечника (ведолизумаб – антитела к α4β7-интегрину); остеопороз (деносумаб – антитела к лиганду рецептора RANK).
В кардиологии известное распространение получили снижающие уровень липопротеидов низкой плотности (ЛПНП) антитела к пропротеин конвертазе субтилизин/кексин типа 9 (PCSK-9) алирокумаб и эволокумаб, абцисимаб (антиагрегант, связывающий GPIIb/IIIa рецепторы тромбоцитов), Fab-фрагменты человеческих антител, связывающие дигоксин и дабигатран (идаруцизумаб).
Клинический эффект МАТ во многом зависит не только от их структуры, определяющей аффинитет к тем или иным мишеням, но и особенностей фармакокинетики.
Антитела представляют собой гетеродимерные протеины, состоящие из двух тяжелых цепей (50 кДа для изотипа G) и двух легких цепей (25 кДа), связанных остатками цистина. Связанные цепи формируют γ-образную молекулу. Каждая цепь молекулы антитела имеет домены вариабельной структуры (VH и VL для тяжелой и легкой цепей), а также домены постоянной структуры (CL, CH1, CH2 и CH3). Два фрагмента антитела, образованные каждый двумя вариабельными и двумя постоянными доменами тяжелой и легкой цепей, называют Fab-фрагментами, или антиген-связывающими фрагментами. Непосредственно интерфейс, сформированный вариабельными доменами на конце Fab-фрагмента, называется паратоп – сайт распознавания антигена антителом. В свою очередь участок с постоянной структурой, состоящей из CH2 и CH3-доменов двух тяжелых цепей, формирует так называемый кристаллизующийся фрагмент (Fc – fragment crystallizable), который может связываться как с компонентами комплемента (например, C1q), так и различными клеточными рецепторами, включая (но не ограничиваясь) неонатальный рецептор (FcRn) и рецептор FcγRs [1].
Химерные антитела (цетуксимаб и ритуксимаб) содержат VL и VH из молекул, полученных от мышей, и СL1–3 и CH1–3, имеющих человеческое происхождение. Дальнейшее замещение структурных компонентов, полученных от мышей, на их человеческие аналоги привело к появлению гуманизированных антител (например, трастузумаб и алемтузумаб).
В итоге появление полностью человеческих антител стало возможным благодаря использованию методики фагового дисплея для отбора структур вариабельных доменов [2].
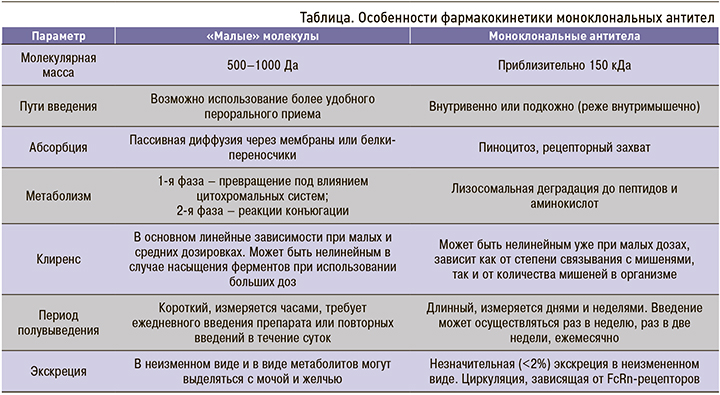
В отличие от малых молекул, фармакокинетика МАТ имеет свои существенные отличия, которые обусловлены сочетанием различных факторов, определяющих распределение и пути элиминации этих молекул (табл.).
ВВЕДЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
МАТ не могут применяться перорально ввиду следующих обстоятельств:
- крупные молекулы крайне плохо (не более 1–2%) всасываются в желудочно-кишечном тракте и не могут создавать предсказуемой системной концентрации;
- белковые структуры подвергаются денатурации в кислой среде желудка;
- в результате денатруации сложные белковые структуры теряют защиту от протеаз [3, 4].
Основные пути введения МАТ в организм – внутривенные и подкожные инъекции.
Всасывание и распределение при введении препаратов под кожу зависят от их способности проникать из интерстициального пространства в лимфатические сосуды. Из-за того что ток лимфы значительно медленнее тока крови, а также с учетом пассивности процесса проникновения крупных молекул в лимфатические сосуды время регистрации максимальной концентрации препарата в крови после его подкожного введения может быть отсрочено и составляет от 2 до 14 дней (при этом для большинства МАТ этот показатель составляет 6–8 дней) [5].
Необходимо также отметить, что при подкожном введении МАТ могут подвергаться пресистемной элиминации за счет присутствия в интерстициальной жидкости протеаз, эндоцитоза и последующей лизосомальной деградации в клетках эндотелия лимфатических сосудов. Кроме того, одним из ведущих путей пресистемной элиминации при этом пути введения является фагоцитоз в лимфатических узлах. Все это определяет уменьшение биодоступности МАТ, которое, по разным данным, составляет от 50 до 80% [5, 6].
На биодоступность МАТ влияет выбор места для инъекций, разная скорость лимфотока, изменяющаяся, например, при активных движениях, различное состояние лимфатических узлов. Нужно также учитывать влияние возраста, пола, состояния кожи, уровня артериаль...












