Клиническая Нефрология №3 / 2021
Открытия японских биохимиков, ломающие традиционные представления о превращении треонина и гистидина в организме человека и значение этих открытий в лечении уремии
Биофизприбор, СКТБ, филиал ФГУП ЭПМ ФМБА России, Санкт-Петербург, Россия
В традиционной биохимии существовало два устоявшихся стереотипа. Первый: все аминокислоты, как заменимые, так и незаменимые, в организме подвергаются обратимому переаминированию с α-кетокислотами, кроме лизина и треонина. При уремии возникает необходимость замещения в малобелковой диете незаменимых аминокислот их α-кетоаналогами в расчете на дальнейшее переаминирование последних, но при этом кетоаналоги лизина и треонина не используют, т.к. считают, что эти две аминокислоты не переаминируются. Японские биохимики еще в конце прошлого века доказали, что в отличие от лизина треонин подвергается переаминированию так же, как и другие аминокислоты. Второй: гистидин не синтезируется в животном организме, в т.ч. в человеческом. Но если для подавляющего большинства млекопитающих гистидин является незаменимой аминокислотой, то для здорового взрослого человека гистидин – заменимая аминокислота. И только в этом веке японские биохимики обнаружили фермент, катализирующий последнюю реакцию на пути биосинтеза гистидина, причем это открытие объясняет незаменимость/заменимость гистидина для того или иного вида животных, включая человека, а также резкое изменение статуса гистидина у больных уремией, что дает веские основания для введения гистидина в организм людей, страдающих почечной недостаточностью. В данной статье показаны эти открытия японских биохимиков и делаются выводы о практическом их применении при уремии.
Введение
Хорошо известно, что белки необходимы для питания человека и животных. Биологическая ценность белка определяется его аминокислотным составом. Одни аминокислоты (незаменимые) не синтезируются в организме при их отсутствии в пище, тогда как другие (заменимые) в аналогичном случае могут синтезироваться в организме. Восемь аминокислот (лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин) необходимы всем исследованным видам животных и являются незаменимыми [1]. Что касается гистидина, то до сих пор идут споры о возможности его синтеза в животном организме, а следовательно, о том, относить его к незаменимым или заменимым аминокислотам.
Необходимо добавить, что под невозможностью синтеза в организме понимается свойственная всем незаменимым аминокислотам необратимость распада их углеродного скелета. Но почти все аминокислоты, как заменимые, так и незаменимые, способны подвергаться обратимому переаминированию с α-кетокислотами. Значительный интерес представляет следующий факт. Отмечено [2], что после того, как крысам и кроликам добавляли в пищу глицин, меченный N15, треонин не содержал этого изотопного маркера (в отличие от других аминокислот, кроме лизина). Отсюда можно сделать вывод: треонин, подобно лизину, не принимает участия в переносе аминогруппы, который наблюдается у других аминокислот, как заменимых, так и незаменимых. Но другие авторы [3] после кормления крыс лейцином, меченным N15, нашли очень небольшое количество метки в треонине. Тот факт, что некоторое количество азота лейцина было обнаружено в молекуле треонина, указывает на наличие в организме животных незначительного синтеза треонина путем переаминирования.
Целью настоящего обзора стало обсуждение открытий японских биохимиков, сделанных в разные годы, но долгое время остававшихся незамеченными в мировой биохимической науке, которые проливают свет на белые пятна в понимании возможности переаминирования треонина и биосинтеза гистидина, а также значения этих процессов для терапии хронической болезни почек (ХБП). Поскольку переаминирование треонина изучено лучше, чем биосинтез гистидина у человека и животных, обзор следует начать с него.
Треонин
Углеродный скелет треонина необратимо распадается в печени млекопитающих под влиянием двух ферментов: треониндегидратазы и треониндегидрогеназы. Крысы ярко демонстрируют невозможность синтеза у млекопитающих углеродного скелета треонина – иными словами, что треонин – незаменимая аминокислота. В то же время именно у крыс в организме был обнаружен N15, введенный в организм с лейцином [3]. Это могло быть только результатом переаминирования, поскольку последнее является единственным способом биосинтеза незаменимых аминокислот у животных.
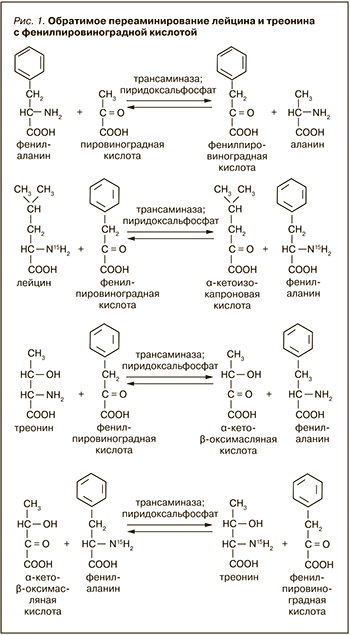 Т. Т. Березов в своей монографии [4] в 1969 г. пишет: считается доказанным, что в тканях млекопитающих механизм переаминирования является главным путем дезаминирования L-аминокислот, и перечисляет их. Cреди аминокислот Т. Т. Березов называет треонин, но не называет лизин, следовательно, он имеет в виду непосредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина (α-аминоадипиновая кислота) активно подвергается переаминированию. Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой. Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого...
Т. Т. Березов в своей монографии [4] в 1969 г. пишет: считается доказанным, что в тканях млекопитающих механизм переаминирования является главным путем дезаминирования L-аминокислот, и перечисляет их. Cреди аминокислот Т. Т. Березов называет треонин, но не называет лизин, следовательно, он имеет в виду непосредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина (α-аминоадипиновая кислота) активно подвергается переаминированию. Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой. Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого...












