Фарматека №2 / 2019
Патогенетическая роль растворимых молекул межклеточной адгезии при воспалительных заболеваниях кишечника
Ростовский государственный медицинский университет, Ростов-на-Дону, Россия
Статья посвящена актуальной проблеме воспалительных заболеваний кишечника (ВЗК). На основании анализа литературы и обобщения практического опыта представлен обзор современных данных, касающихся иммунопатогенеза ВЗК. Открытым до сих пор остается вопрос о роли молекул адгезии при язвенном колите (ЯК) и болезни Крона (БК). В последние годы особое внимание уделяется блокированию активной миграции лейкоцитов в слизистую оболочку кишечника и ключевым полифункциональным сигнальным молекулам – интегринам, основная роль которых заключается в обеспечении механического контакта лейкоцитов с эндотелием. В данном обзоре авторы сосредоточили внимание на строении и функциях основных классов молекул адгезии, а также на изменении сывороточных показателей адгезивных факторов в зависимости от активности воспалительного процесса в кишке пациентов с ЯК и БК. Указанная проблема мало изучена и требует дальнейших исследований.
Для цитирования: Тарасова Г.Н., Яковлев А.А., Добаева Н.В. Патогенетическая роль растворимых молекул межклеточной адгезии при воспалительных заболеваниях кишечника. Фарматека. 2019;26(2):31–36. DOI: https://dx.doi.org/10.18565/pharmateca.2019.2.31-36
Несмотря на значительные успехи фундаментальной медицины, до настоящего времени четко не определены этиопатогенетические факторы, ответственные за развитие и формирование персистенции воспалительного процесса при язвенном колите (ЯК). Последние годы вектор научных исследований направлен на изучение изменений иммунологической реактивности при воспалительных заболеваниях кишечника (ВЗК).
По мнению большинства исследователей, ведущая роль в иммунопатогенезе ВЗК принадлежит молекулам адгезии (МА) [1–3], которые запускают сложную энергозависимую миграцию лейкоцитов из кровотока в зону тканевого поражения, т.н. хоминг лейкоцитов [4].
Хоминг, в результате которого лейкоциты пересекают эндотелиальный барьер, это многоэтапный процесс, начинающийся с захвата и роллинга лейкоцитов на стенке кровеносного сосуда с последующей прочной адгезией к эндотелиальным клеткам и миграцией в очаг воспаления [5] (рис. 1). Установлено, что повышение адгезии имеет большое значение в патогенезе дисфункции эндотелия и коррелирует с активностью воспаления [6].
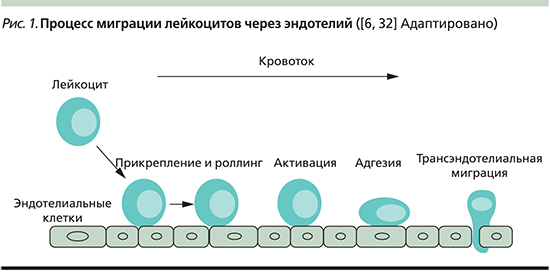
По данным литературы, увеличение в сыворотке крови уровня МА и нарушение рекрутинга лейкоцитов регистрируются при широком круге иммуноопосредованных хронических воспалительных, инфекционных и аллергических заболеваний, например при ревматоидном артрите, псориазе, рассеянном склерозе, ВЗК [7]. Вместе с тем, несмотря на массу публикаций, освещающих вопросы патофизиологии и иммунопатогенеза ВЗК, имеющиеся результаты, полученные в ex vivo- и in vitro-исследованиях, отражающие роль МА, особенно суперсемейства иммуноглобулинов, в развитии воспаления при ЯК малочисленны и нередко противоречивы.
Выделяют несколько классов МА, которые имеют принципиально общую схему строения и служат мембранными белками: селектины (P, L, E), интегрины, молекулы суперсемейства иммуноглобулинов (IgSF), у млекопитающих выделена дополнительная группа, представленная кадгеринами [8].
Суперсемейство иммуноглобулинов составляют VCAM (CD106;vascular cell adhesion molecule), ICAM (intercellular adhesion molecules), содержащую ICAM-1 (CD54), ICAM-2 (CD102), ICAM-3 (CD50), ICAM-4 (вещество эритроцитов Ландштейнера–Винера), ICAM-5 (телеэнцефалин), а также PECAM (platelet-endothelial cell adhesion molecule) [9].
Установлено, что ICAM-1 – высокогликозилированный трансмембранный белок, постоянно экспрессирующийся в небольших количествах на негемопоэтических клетках, таких как клетки сосудистого эндотелия, эпителия вилочковой железы, кератиноциты и фибробласты, а также на гемопоэтических клетках – моноцитах, некоторых субпопуляциях T- и B-клеток [10]. Известно, что ICAM-1 активируется под воздействием провоспалительных сигналов фактора некроза опухолей α (ФНО-α), интерлейкина-1β и интерферона-γ. Уровень синтеза ICAM-1 и ICAM-2 на моноцитах сопоставим, но в отличие от ICAM-1 экспрессия ICAM-2 не подвергается дополнительному влиянию воспалительных цитокинов [11].
Интегрины представляют трансмембранные гетеродимерные МА, образованные двумя нековалентно связанными субъединицами: α (120–170 кДа) и β (90–100 кДа). У позвоночных описаны 18 α- и 8 β-субъединиц, которые комбинируются для генерации по меньшей мере 24 различных вариантов интегринов, 14 из которых присутствуют в клетках иммунной системы [12]. Столь значительное количество возможных комбинаций обеспечивает широкое функциональное разнообразие этих молекул [3]. При этом специфичность интегрина определяет β-субъединица. Именно поэтому β2 (CD18), α4 и β7 семейства интегринов играют наиболее важную роль в индукции воспалительных состояний [13]. β1-интегрины взаимодействуют с компонентами межклеточного матрикса и мембранным рецептором VCAM-1 (СD106), который экспрессируется активированными клетками эндотелия [8]. β2-интегрины представлены на лейкоцитах, и их экспрессия широко варьируется среди лейкоцитарных субпопуляций [13]. В качестве рецепторов для β2-интегринов, способных конкурентно тормозить процессы межклеточных взаимодействий, выступают мембранные молекулы, образующие группу ICAM [8].
Интегрины могут существовать в клетке в нескольких формах: активной, неактивной и промежуточной. Активированные интегрины участвуют в опосредовании клеточной адгезии. При этом прочность клеточной адгезии, связанной с интегрином, определяется как авидность последнего [14]. В свою очередь авидность определяет прочность индивидуальной связи между одним интегрином и его лигандом и регулируется конфигурацией субъединиц интегрина, тогда как валентность интегрина опосредуется кластеризацией его рецеп...












