Фарматека №16 (210) / 2010
Постоянная подкожная инфузия инсулина: эффективный метод контроля сахарного диабета типа 1
Рассматриваются современные способы введения инсулина, отражены основные преимущества постоянной подкожной инфузии инсулина c помощью помпы перед режимом многократных инъекций инсулина. Представлены результаты клинических исследований, подтверждающие эффективность и преимущества помповой терапии, а именно устранение феномена "утренней зари", уменьшение суточной вариабельности гликемии, снижение уровня гликированного гемоглобина, уменьшение потребности в инсулине, снижение частоты развития гипогликемий и кетоацидоза. Описаны основные корригируемые и некорригируемые факторы, поддерживающие хроническую декомпенсацию диабета. Подчеркнута невозможность достижения хорошей компенсации диабета без участия самого пациента, а также при его недостаточной осведомленности о заболевании и работе прибора.
Сахарный диабет (CД) относится к группе социально значимых заболеваний, характеризуется высокой распространенностью, постоянной тенденцией к росту заболеваемости, хроническим течением, высокой частотой развития осложнений и инвалидизации.
В соответствии с определением ВОЗ CД – это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая является результатом дефектов секреции инсулина, действия инсулина или обоих этих факторов.
В России, как и в других странах мира, ежегодно увеличивается число больных СД. По данным экспертов ВОЗ, общее количество больных к 2025 г. превысит 350 млн человек [11]. При этом в общей структуре диабета на долю СД типа 1 (СД1) приходится 3–6 %.
Известно, что при СД риск развития микро- и макрососудистых осложнений ассоциируется с возрастом пациента, длительностью заболевания и степенью компенсации углеводного обмена. Достижение оптимального контроля углеводного обмена на протяжении всей жизни больного является важнейшим фактором профилактики поздних осложнений СД.
Применяемые в настоящее время в России терапевтические цели контроля заболевания у взрослых больных СД1 отражены в алгоритмах специализированной медицинской помощи при СД [2] и представлены в таблице.
Примечание. HbA1c – гликированный гемоглобин.
Достижение таких показателей углеводного обмена реально у обученных пациентов с высоким уровнем мотивации, обеспеченных инновационными препаратами инсулина и средствами его введения, при регулярном проведении самоконтроля гликемии и адекватной коррекции доз вводимого инсулина.
Необходимость поддержания показателей гликемии у пациентов с СД1, особенно молодого возраста, близких к физиологическим значениям, подтверждена данными одного из фундаментальных клинических исследований (DCCT). В исследовании рассматривалось влияние различных режимов лечения СД1 на частоту развития и степень тяжести поздних осложнений диабета. Оценка конечных результатов осуществлялась в двух группах пациентов. Первая группа включала 726 человек без признаков осложнений, характерных для СД, в частности ретинопатии (группа первичной профилактики). Во вторую группу входили 715 пациентов с признаками ретинопатии (группа вторичной профилактики). В каждой группе одним пациентам назначалась традиционная терапия, другим – интенсивная терапия. Средняя продолжительность наблюдения за больными составила 6,5 лет.
У пациентов без диабетической ретинопатии (группа первичной профилактики) интенсивная терапия при частом измерении содержания глюкозы в крови снижала риск развития данного осложнения минимум на 34 %, а максимально – на 76 % в зависимости от способов выявления исходной тяжести CД.
Интенсивная терапия оказывала благоприятное воздействие и на пациентов с признаками ретинопатии. На начальном этапе наблюдения у пациентов, находящихся на интенсивной терапии, прогрессирование ретинопатии выявлялось на 54 % реже, чем у больных, получавших традиционную терапию.
У пациентов, находившихся на интенсивной терапии, на 35 % сократилась частота поражения почек, которое оценивалось по уровню микроальбуминурии. Использование интенсивной терапии привело к уменьшению клинически значимой микроальбуминурии в целом по группе на 56 %. Интенсивное лечение сокращало риск развития клинически значимой нейропатии на 60 % (в группе в целом). В группе первичной профилактики этот риск уменьшался на 70 % [7, 18].
Поскольку в основе патогенеза СД1 лежит абсолютный дефицит инсулина в результате поражения β-клеток поджелудочной железы, единственным способом его лечения является заместительная терапия в виде интенсифицированной инсулинотерапии (ИИТ).
Цель заместительной инсулинотерапии больных СД – это достижение компенсации заболевания путем имитации нормальной физиологической секреции инсулина. В соответствии с международными и российскими рекомендациями в целях больных СД желательно использовать человеческий генно-инженерный инсулин и его аналоги. В физиологических условиях высвобождение инсулина складывается из базальной (постоянной) секреции для поддержания основного обмена и болюсной (пищевой) секреции, представляющей собой усиленную секрецию в ответ на прием пищи или гипергликемию (рис. 1).
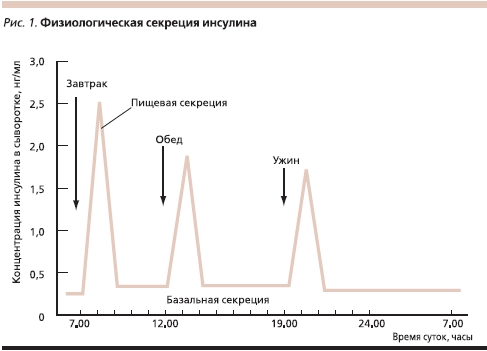
При проведении заместительной терапии инсулином схемы его введения должны быть максимально приближенными к режиму физиологической секреции инсулина β-клетками поджелудочной железы. Исторически введение инсулина осуществлялось с помощью шприцов. Первый в мире шприц для введения инсулина был выпущен в 1924 г. В настоящее время для этой цели все чаще используют многоразовые шприц-ручки со сменными картриджами или заправленные инсулином одноразовые шприц-ручки (флекспены). С помощью как шприцов, так и шприц-ручек введение инсулина осуществляется в основном в базис-болюсном режиме: инсулин к...












