Эпидемиология и Инфекционные болезни. Актуальные вопросы №2 / 2016
Применение небустированного атазанавира в клинической практике
1Центральный НИИ эпидемиологии Роспотребнадзора, Москва; 2 ООО «Бристол-Майерс Сквибб», Москва
В статье приведены результаты применения небустированного атазанавира (АТV) в клинических исследованиях и реальной клинической практике. Сравнение схем, включающих бустированный и небустированный АТV, показало одинаково высокую эффективность, но лучший профиль безопасности при использовании препарата без ритонавира. Несмотря на повышение уровня непрямого билирубина у ряда пациентов, принимающих АТV, желтуха развивается только у 10% больных, уровень трансаминаз не изменяется, и лишь у 1–2% больных требуется отмена препарата из-за гипербилирубинемии (ГБР). Определены предикторы ее развития, связанные как с особенностями пациента (дефицит UGT1A1), так и с фармакокинетикой препарата. В нескольких исследованиях (NCT00440947, ARIES, ASSURE) было показано, что замена бустированного АТV на небустированный сокращает более чем в 2 раза вероятность развития не только ГБР, но и любых побочных эффектов за счет изменения фармакокинетики и снижения концентрации препарата в плазме. В статье приводятся результаты нескольких исследований, где неусиленный АТV использовали для упрощения схем АРТ. После переключения пациентов со стабильной вирусологической супрессией на упрощенную схему сокращалось суточное количество принимаемых таблеток, значимо улучшались липидные показатели, уменьшалась частота ГБР при эквивалентной эффективности режимов и низкой вероятности неудачи лечения.
Согласно результатам многочисленных исследований, атазанавир (ATV), относящийся к классу ингибиторов протеазы (ИП) ВИЧ, является высокоэффективным препаратом как для пациентов, только начинающих антиретровирусную терапию (АРТ), так и для больных с опытом лечения или предшествующей вирусологической неудачей. Препарат был зарегистрирован в России в 2005 г., а широкое его использование в мире насчитывает уже более 10 лет.
ATV обладает хорошим профилем безопасности и хорошо переносится пациентами. Среди нежелательных явлений наиболее часто встречается повышение уровня непрямого билирубина, которое обратимо, поддается коррекции и не связано с развитием гепатотоксичности. Рандомизированные контролируемые исследования по использованию ИП [1–3] показали, что большинство препаратов этого класса вызывает клинически значимое повышение уровня триглицеридов и холестерина. К безусловным достоинствам ATV нужно отнести отсутствие влияния на липидный, а также углеводный профиль, что позволило использовать этот препарат у пациентов старшего возраста, больных кардиоваскулярными заболеваниями и сахарным диабетом [4, 5].
ATV обладает уникальным преимуществом – возможностью использования как с усилением ритонавиром (RTV), так и в качестве самостоятельного препарата. При этом эффективность его эквивалентна, а параметры безопасности существенно лучше. Это связано с собственными побочными эффектами RTV, а также с усилением токсичности других ИП при сочетанном применении.
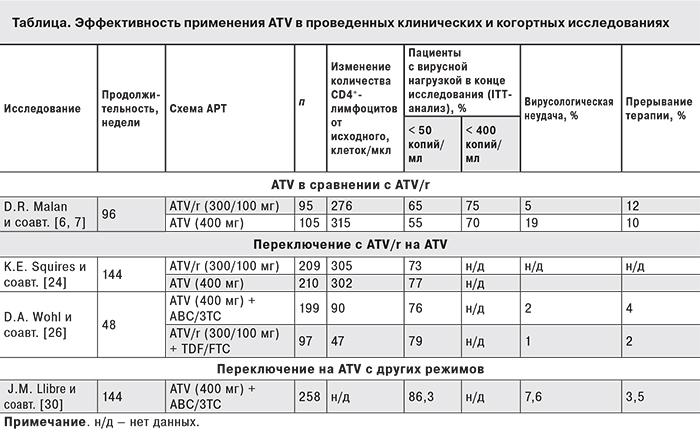
Важным моментом в совершенствовании и расширении подходов к лечению стал сравнительный анализ схем, включающих бустированный (ATV/r) и небустированный ATV у не леченных ранее пациентов. С этой целью было проведено многоцентровое рандомизированное открытое международное клиническое исследование III фазы BMS AI424-089 [6, 7]. Через 48 (первичная цель) и 96 нед. оценивали долю пациентов с концентрацией РНК ВИЧ < 400 и < 50 копий/мл, изменение количества CD4+-лимфоцитов и проводили анализ параметров безопасности. В исследование было включено 200 пациентов, из которых 95 получали ATV 300 мг в сочетании с RTV 100 мг однократно (1-я группа), а 105 – ATV 400 мг однократно (2-я группа). В качестве базовой терапии применяли ламивудин (3ТС) и ставудин (d4T).
Характеристики пациентов до начала лечения были сходными в обеих группах. Исходно медиана количества CD4+-лимфоцитов составила около 200 клеток/мкл, концентрация РНК ВИЧ – 4,95 log копий/мл, а уровня холестерина и триглицеридов – 161 и 145 мг/дл соответственно.
На 48-й неделе пропорция больных с вирусной нагрузкой ВИЧ < 400 копий/мл составила 86 и 85%, а < 50 копий/мл – 70 и 75% в 1-й и 2-й группах соответственно (включая всех пациентов, даже больных с вирусной неудачей – ITT-анализ). При использовании в анализе данных только пациентов, завершивших исследование (ОT-анализ), были получены следующие результаты: вирусной нагрузки < 400 копий/мл достигли по 93% пациентов в каждой группе, < 50 копий/мл – 76 и 87% в 1-й и 2-й группах соответственно. На 96-й неделе исследования пропорция пациентов с уровнем РНК ВИЧ < 400 и < 50 копий/мл составила 75 и 65% в 1-й группе и 70 и 55% во 2-й группе (различия статистически недостоверны). Эти результаты соответствовали предопределенным протоколом критериям равной эффективности (см. таблицу).
Увеличение количества CD4+-лимфоцитов по сравнению с исходным было сопоставимо в двух ветвях исследования: прирост в 1-й группе составил 189 клеток/мкл, во 2-й – 224 клеток/мкл на 48-й неделе, 276 и 315 клеток/мкл на 96-й неделе соответственно (различия статистически недостоверны).
Вирусологическая неудача на 48-й неделе была зарегистрирована в 3 и 10% случаев у пациентов 1-й и 2-й групп соответственно, на 96-й неделе – в 5 и 19% случаев. Пациенты 1-й группы с вирусологической неудачей сохранили фенотипическую чувствительность к ATV, в то время как во 2-й группе из 20 пациентов с неудачей у 4 была зарегистрирована потеря чувствительности ВИЧ к ATV.
Повышение концентрации холестерина наблюдали в 15% случаев в 1-й группе по сравнению с 6% во 2-й (р < 0,01). Повышение уровня триглицеридов чаще имело место при применении ATV/r (26 и 3% в 1-й и 2-й группах соответственно; р < 0,01). На 96-й неделе по сравнению с 48-й неделей изменения были минимальны (различия между группами сохранялись, за исключением концентрации триглицеридов), что указывает на отсутствие повышения риска с продолжением терапии. Прерывание терапии в течение 48 нед. было зафиксировано у 12% пациентов 1-й группы и у 10% пациентов 2-й группы. Анализ причин прерывания АРТ показал, что в связи с развитием нежелательных явлений (главным образом, гипербилирубинемии – ГБР) лечение прервали 8% пациентов в 1-й группе и лишь 1% больных во 2-й группе. Более половины случаев преждевременной отмены терапии произошло по причине предопределенных протоколом требований по отмене терапии ATV/r в случае персистирования ГБР 4-й степени, даже в случае отсутствия клинических симптомов. Случаев прерывания терапии между 48-й и 96-й неделями не зарегистрировано. Было сообщено о желтухе у 3% пациентов в 1-й группе и у менее 1% во 2-й. ГБР 3–4 степени была зафиксирована на 48-й неделе у 59 и 20%, на 96-й неделе – у 66 и 24% пациентов, получавших соответственно ATV/r и ATV.
Таким образом, в данном исследовании был продемонстрирован высокий и сравнимый между группами уровень вирусологического ответа на протяжении 96 нед. Безопасность и переносимость обеих схем была достаточно хорошей. Вместе с тем, использование ATV без RTV не только сокращает суточное количество таблеток, но и реже вызывает повышение уровня билирубина, а также нарушение липидного обмена. В то же время ATV/r характеризуется лучшим профилем резистентности.
В настоящее время среди практических врачей распространено мнение о том, что повышение уровня билирубина в процессе терапии ATV является поводом для отмены этого препарата и перехода на другие схемы АРТ. Действительно, во всех клинических исследованиях с использованием ATV было зафиксировано повышение уровня непрямого билирубина у 30–50% пациентов. Однако изменение этого лабораторного параметра достигает 4-й степени выраженности только у 1–2% больных, не влечет за собой повышения уровня трансаминаз и не нарушает функцию печени. По данным многочисленных исследований (CASTLE, SIMPATAZ и др.), частота желтухи составляла только 4–10%, при этом повышение уровня трансаминаз наблюдали всего в 2% случаев [8, 9]. ATV способствует снижению концентрации уридиндифосфат-глюкуронилтрансферазы (UGT1A1), что по патофизиологическому механизму аналогично синдрому Жильбера или физиологической желтухе новорожденных [10, 11]. Схему лечения обычно не меняют, если уровень билирубина не превышает 60–8...
>>











