Фарматека №3 / 2025
Прогностическое значение низкого уровня экспрессии HER2 у пациентов c ранним раком молочной железы
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Обоснование: Более 50% случаев рака молочной железы (РМЖ) в настоящее время определяются с более низкими уровнями экспрессии белка HER2 (HER2-low): HER2 – 1+ или 2+ с негативной ISH. Большинство имеющихся данных ретроспективных анализов не обнаружили, что низкая экспрессия HER2 имеет значимое прогностическое значение.
Цели исследования: сравнительный анализ отдаленных результатов лечения у пациентов с ранним РМЖ в зависимости от уровня экспрессии HER2- и HR-cтатуса, анализ показателей выживаемости в группах пациентов с разными уровнями экспрессии HER2, в зависимости от менопаузального статуса.
Материалы и методы: В исследование были включены 265 пациенток с РМЖ (сo II стадией), получавших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава РФ в период с 2011 по 2019 г. Пациентки были распределены в группы в зависимости от уровня экспрессии HER2 и HR-статуса. Далее все пациентки были распределены в 2 группы в зависимости от менопаузального статуса, далее – на подгруппы в зависимости от уровня экспрессии HER2 и HR-статуса. Результаты: Проанализированы данные 265 пациенток с РМЖ, включая 97 (36,6%) случаев с HER2-low, из которых 71 – с HR+ (73,2%) и 26 (26,8%) пациенток – с HR-. При анализе выживаемости статистически значимых различий не наблюдалось, но худшая 5-летняя безрецидивная выживаемость (БРВ) составила 73,1% у пациенток с HR-/HER2-low против 76% при HR-/HER2-0. Показатели общей выживаемости (ОВ) равнялись 88,5% при HR-/HER2-low и 98% соответственно. Также в подгруппе HR-/HER2+ показатели БРВ были низкими – 71,4%, OВ – 94,3%. У пременопаузальных пациенток 5-летняя БРВ составила 74,3% в подгруппе HR+/HER2-low против HR+/HER2+ – 93,9% (p=0,010). У постменопаузальных пациенток при анализе БРВ и ОВ статистически значимых различий не было.
Выводы: Самые низкие показатели БРВ и ОВ наблюдались у пациенток с HR-/HER2-low опухолями. У пременопаузальных пациенток наблюдались более низкие показатели БРВ при HR+/HER2-low против HR+/HER2+ (74,3% против 93,9%). Необходимы дальнейшие исследования для оценки взаимосвязи гормональных рецепторов между их уровнями и величины экспрессии HER2.
Введение
HER2-позитивный рак молочной железы (РМЖ), определяемый путем выявления амплификации гена HER2 и/или сверхэкспрессией на уровне белка HER2, составляет около 20% от всех случаев РМЖ. Данный биологический подтип обладает более агрессивным клиническим течением и худшим прогнозом при отсутствии лечения [1–3]. Однако разработка и внедрение в практику различных лекарственных агентов, воздействующих на HER2, обеспечила значительные клинические преимущества на ранних и поздних стадиях заболевания, изменив траекторию его естественного течения [4–10].
Диагноз HER2-положительного РМЖ в настоящее время основан на обнаружении сверхэкспрессии белка HER2 при иммуногистохимическом исследовании (оценка IHC 3+) или выявлении амплификации гена HER2 при гибридизации in situ (ISH) [11]. Учитывая отсутствие сверхэкспрессии белка HER2 или амплификации гена, HER2-отрицательные опухоли исторически классифицировались и лечились только на основании экспрессии гормональных рецепторов с выделением двух основных клинических подтипов: гормон-рецептор позитивные (ER+/HER2-) и трижды негативные опухоли (ТНРМЖ) [12]. Следует отметить, что, несмотря на выявление HER2-отрицательного статуса, большинство этих опухолей содержат некоторое количество белка HER2 на клеточных мембранах, причем примерно две трети гормон-рецептор-позитивных (ER+/HER2-) и одна треть ТНРМЖ (ER-/HER2-) имеют HER2-низкую экспрессию (HER2 IHC оценка 1+ или 2+/ISH-) [13]. В первых клинических испытаниях терапия моноклональными антителами не показала значимых клинических преимуществ, в т.ч. в крупных исследованиях адъювантной терапии III фазы при HER2-низкой экспрессии [14, 15]. Тем не менее разработка конъюгата моноклонального антитела с лекарственным средством к HER2 (ADC) позволила эффективно воздействовать при лечении больных даже с низкой экспрессией HER2 [16]. Различные конъюгаты моноклонального антитела с лекарственным средством к HER2 продемонстрировали противоопухолевую активность на ранних фазах клинических испытаний с участием пациенток с метастатическим РМЖ с низким уровнем HER2, включая трастузумаб дерукстекан (T-DXd), трастузумаб дуокармазин, диситамаб ведотин, MRG002, SHR-A1811 и другие [17–21]. Важно отметить, что исследование фазы III DESTINY-Breast04 (DB-04) продемонстрировало, что T-DXd улучшает общую выживаемость (ОВ) по сравнению со стандартной химиотерапией (ХТ) среди пациентов с предварительно пролеченным метастатическим РМЖ с низким уровнем экспрессии HER2 [22]. Эти данные подтвердили клиническую значимость низкой экспрессии HER2 при РМЖ (HER2 IHC оценка 1+ или 2+/ISH-).
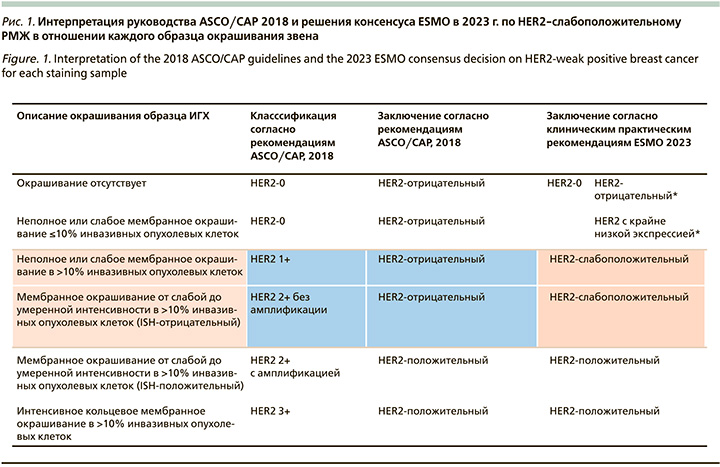
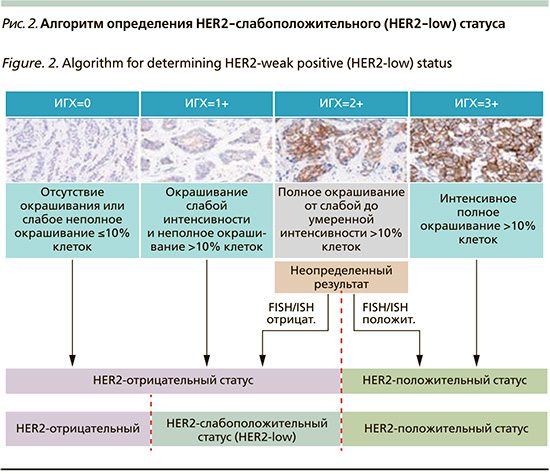
Американское общество клинической онкологии (ASCO) и Колледж американских патологоанатомов (CAP) 22 марта 2023 г. опубликовали обновления шаблонов для предоставления результатов тестирования при первичных инвазивных карциномах молочной железы и при рецидивирующих и метастатических опухолях, включающие примечания для низкой экспрессии биомаркера HER2 (HER2-low). Согласно решению консенсуса ESMO в 2023 г., образцы с окрашиванием с помощью иммуногистохимии (ИГХ) 1+ или 2+/ISH- также можно рассматривать как HER2-слабоположительные (рис. 1, 2), [11, 23].
Цель исследования: сравнительный анализ непосредственных и отдаленных результатов лечения у пациенток с ранним РМЖ в зависимости от уровня экспрессии HER2- и HR-cтатуса. Оценка выживаемости у пациенток с разными уровнями экспрессии HER2 в зависимости от менопаузального cтатуса.
Методы
Выполнен ретроспективный анализ данных пациенток, закончивших лечение на базе отделения опухолей молочной железы ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. В исследование были включены пациентки с РМЖ со II клинической стадией, проходивших первичн...












