Терапия №8 / 2020
Ранние нарушения углеводного обмена при длительной андрогенной депривации агонистами лютеинизирующего гормона рилизинг-гормона
1) ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России, г. Москва;
2) ГБУЗ «Городская клиническая больница имени Д.Д. Плетнева Департамента здравоохранения города Москвы»;
3) ГБУЗ «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
В 90-х гг. прошлого века была постулирована ассоциация низкого уровня тестостерона у мужчин и сахарного диабета (СД) 2 типа [1]. В исследованиях гипогонадизм был определен как предиктор развития СД 2 типа [2].
Известно, что ятрогенный гипогонадизм используется при лечении рака предстательной железы (РПЖ) – одного из самых распространенных опухолевых заболеваний у мужчин во всем мире и в России [3]. Совершенствование протоколов ведения таких пациентов способствует существенному увеличению продолжительности их жизни [4, 5]. В то же время андрогендепривационная терапия может становиться ящиком Пандоры в связи c увеличением риска развития СД 2 типа и сердечно-сосудистых рисков.
Большое количество исследований изучали кардиометаболические исходы андрогендепривационной терапии (АДТ) [6, 7]. Значительные изменения в метаболических показателях и параметрах состава тела отмечаются у пациентов даже после 1 или 3 мес такой терапии [8, 9]. По данным проспективного исследования с участием 32 мужчин, получавших в течение 12 мес агонист лютеинизирующего гормона рилизинг-гормона (аЛГРГ), у пациентов за указанный срок наблюдалось возрастание веса на 2,4%, увеличение жировых отложений на 9,4% и снижение мышечной массы на 2,7%, что сопровождалось повышением концентрации инсулина (а это предполагает снижение чувствительности к инсулину и повышение инсулинорезистентности) [10].
Еще одно перспективное исследование 25 пациентов без диабета продемонстрировало, что даже краткосрочное применение AДT в течение 12 нед вызвало снижение чувствительности к инсулину на 12,8% и повышение уровня инсулина в плазме натощак на 25,9%, а также значимое повышение уровня гликированного гемоглобина (HbA1c) и увеличение жировой массы [11].
В американском исследовании проводилось сравнение пациентов, получающих АДТ, пациентов с РПЖ, но без АДТ, и здоровых людей [12]. С поправкой на возраст и индекс массы тела (ИМТ) было показано, что мужчины в группе AДT имели значительно более высокий уровень глюкозы плазмы натощак, инсулина, лептина и индекс HOMA по сравнению с обеими группами. Выявлена значимая отрицательная корреляция между уровнем общего и свободного тестостерона с глюкозой натощак, инсулином, лептином и HOMA-IR. Это исследование продемонстрировало также независимость неблагоприятных метаболических изменений от возраста и ИМТ.
В обсервационном популяционном исследовании 73 196 мужчин в возрасте 66 лет и старше с РПЖ оценивали влияние аЛГРГ и орхиэктомии на развитие СД, ишемической болезни сердца (ИБС), инфаркта миокарда (ИМ) и внезапной сердечной смерти. Была обнаружена ассоциация использования аЛГРГ с повышенным риском развития СД, ИБС, ИМ, внезапной сердечной смерти [13].
 Немало исследований подтвердило связь АДТ с развитием СД [6, 7, 14], однако точные молекулярные механизмы влияния такой терапии на развитие инсулинорезистентности (ИР) и гипергликемии остаются малоизученными. В японском исследовании выявлено не только достоверное повышение гликемии, но и снижение функции β-клеток у пациентов с РПЖ, получающих АДТ [15]: это позволяет предположить, что тяжелый дефицит андрогенов нарушает функцию β-клеток и приводит к неспособности компенсировать ИР [16, 17]. В условиях эксперимента in vivo и in vitro Navarro G. et al. изучали культуру β-клеток островков поджелудочной железы животных и регуляцию глюкозозависимой стимуляции секреции инсулина. Авторы выявили новый негеномный механизм, с помощью которого внеядерный андрогенный рецептор и его паракринное взаимодействие с α-островковыми клетками регулируют рецептор глюкагоноподобного пептида-1 (ГПП-1), который стимулирует функцию β-клеток. Было отмечено снижение глюкозозависимой секреции инсулина с развитием гипергликемии при использовании диеты с высоким содержанием жиров, а также при блокировании андрогенных рецепторов и действия тестостерона [17]. Авторами выявлено, что андрогенный рецептор на β-клетках стимулирует глюкозозависимую секрецию инсулина путем увеличения внутриклеточного биосинтеза цАМФ и таким образом активирует цАМФ-зависимую протеинкиназу А. Кроме того, инсулинотропный эффект тестостерона был опосредован через активацию рецепторов ГПП-1 на островковых клетках с помощью паракринных механизмов. Эти данные подтверждают потенциальную роль дефицита андрогенов в повышении риска развития СД 2 типа, а также обосновывают новые терапевтические подходы, которые могут помочь в профилактике и/или лечении нарушений углеводного обмена. Вместе с тем на данный момент остаются без ответа вопросы о том, какие показатели углеводного обмена являются наиболее репрезентативными у этой группы пациентов, когда нужно их оценивать, какие антидиабетические препараты могут использоваться и на каком этапе.
Немало исследований подтвердило связь АДТ с развитием СД [6, 7, 14], однако точные молекулярные механизмы влияния такой терапии на развитие инсулинорезистентности (ИР) и гипергликемии остаются малоизученными. В японском исследовании выявлено не только достоверное повышение гликемии, но и снижение функции β-клеток у пациентов с РПЖ, получающих АДТ [15]: это позволяет предположить, что тяжелый дефицит андрогенов нарушает функцию β-клеток и приводит к неспособности компенсировать ИР [16, 17]. В условиях эксперимента in vivo и in vitro Navarro G. et al. изучали культуру β-клеток островков поджелудочной железы животных и регуляцию глюкозозависимой стимуляции секреции инсулина. Авторы выявили новый негеномный механизм, с помощью которого внеядерный андрогенный рецептор и его паракринное взаимодействие с α-островковыми клетками регулируют рецептор глюкагоноподобного пептида-1 (ГПП-1), который стимулирует функцию β-клеток. Было отмечено снижение глюкозозависимой секреции инсулина с развитием гипергликемии при использовании диеты с высоким содержанием жиров, а также при блокировании андрогенных рецепторов и действия тестостерона [17]. Авторами выявлено, что андрогенный рецептор на β-клетках стимулирует глюкозозависимую секрецию инсулина путем увеличения внутриклеточного биосинтеза цАМФ и таким образом активирует цАМФ-зависимую протеинкиназу А. Кроме того, инсулинотропный эффект тестостерона был опосредован через активацию рецепторов ГПП-1 на островковых клетках с помощью паракринных механизмов. Эти данные подтверждают потенциальную роль дефицита андрогенов в повышении риска развития СД 2 типа, а также обосновывают новые терапевтические подходы, которые могут помочь в профилактике и/или лечении нарушений углеводного обмена. Вместе с тем на данный момент остаются без ответа вопросы о том, какие показатели углеводного обмена являются наиболее репрезентативными у этой группы пациентов, когда нужно их оценивать, какие антидиабетические препараты могут использоваться и на каком этапе.
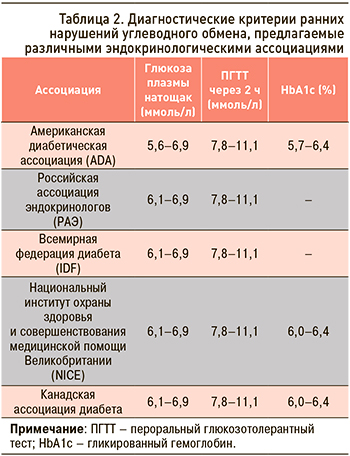
Целью нашего исследования было изучение влияния АДТ препаратами из группы аЛГРГ у пациентов с местно-распространенным РПЖ (МРРПЖ) на параметры углеводного обмена.
МАТЕРИАЛ И МЕТОДЫ