Эпидемиология и Инфекционные болезни. Актуальные вопросы №6 / 2016
Ретроспективный эпидемиологический анализ случаев туберкулеза легких у многократно госпитализированных больных
1Северо-Западный государственный медицинский университет им. И.И. Мечникова Минздрава России, Санкт-Петербург;
2 НИИ эпидемиологии и микробиологии имени Пастера, Санкт-Петербург
3 Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии Минздрава России
Цель исследования. Молекулярно-эпидемиологический анализ случаев заболевания туберкулезом (ТБ) легких и установление факторов риска рецидива и обострения ТБ у пациентов, многократно госпитализированных в противотуберкулезные учреждения.
Материалы и методы. Проведено генотипирование (сполиготипирование, MIRU-VNTR- и IS6110-RFLP-типирование) 73 серийных изолятов Mycobacterium tuberculosis 34 больных ТБ легких (рецидив – у 10, прогрессирование – у 24).
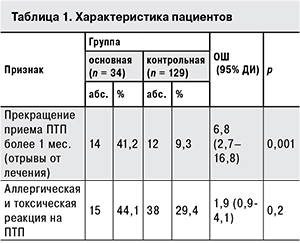
Результаты. Установлена ассоциация риска экзогенного инфицирования штаммами M. tuberculosis с множественной лекарственной устойчивостью с многократными госпитализациями в противотуберкулезные учреждения [OШ = 10,5; 95% ДИ (1,0–108); p = 0,02]. Все случаи рецидива и 79,2% случаев прогрессирования заболевания были вызваны M. tuberculosis генетического семейства Beijing. Выявлена вариабельность спектра лекарственной чувствительности, а также профилей IS6110-RFLP и MIRU-VNTR серийных изолятов M. tuberculosis наиболее распространенных в России генотипов Beijing (вариантов В0, А0, А10) и LAM9 (сполиготипы SIT252, SIT150). Вариабельность генотипов серийных изолятов M. tuberculosis 5 (14,7%) из 34 больных была обусловлена смешанной инфекцией и/или экзогенной инфекцией (предположительно при бронхоскопии) в условиях противотуберкулезного стационара. Фактором риска рецидива или прогрессирования процесса был отрыв от лечения [OШ = 6,8; 95% ДИ (2,7–16,8); p < 0,001].
Заключение. Результаты генотипирования и анализ спектра лекарственной чувствительности серийных изолятов M. tuberculosis, полученных от больных ТБ легких, позволяют выявить факторы риска при рецидиве и обострении заболевания.
Этиопатогенез туберкулеза (ТБ) традиционно связывали с инфицированием пациента одним штаммом туберкулезных микобактерий (Mycobacterium tuberculosis complex), поэтому рецидив после проведенного курса химиотерапии считали результатом реактивации процесса, обусловленного тем же штаммом возбудителя. Однако начиная с 70-х годов прошлого века, по мере совершенствования методологии внутривидового типирования микобактерий, были накоплены доказательства возможности первичного инфицирования несколькими штаммами и экзогенной реинфекции штаммом M. tuberculosis, отличным от выделенного первично [1–3]. В настоящее время генотипическая и фенотипическая неоднородность штаммов M. tuberculosis и вероятность смешанной инфекции (mixed infection) при туберкулезе не вызывают сомнения [4, 5].
Под смешанной инфекцией понимают присутствие в организме больного ТБ двух или более штаммов возбудителя одновременно [1, 6]. Так, по данным I. Shamputa и соавт. [6], доля смешанных субпопуляций возбудителя составила 8,2% при анализе 97 изолятов M. tuberculosis, полученных от вновь выявленных больных до начала лечения противотуберкулезными препаратами (ПТП). На территориях с высоким уровнем заболеваемости ТБ частота смешанной инфекции достигает 20–26% [5, 7].
Клинико-эпидемиологические особенности туберкулезной инфекции не всегда позволяют определить точное время и место заражения, а в связи с этим достоверно установить источник и обстоятельства инфицирования. Полагают, что возможно как одномоментное инфицирование несколькими штаммами возбудителя (собственно смешанная инфекция), так и последовательное инфицирование на протяжении длительного латентного периода, когда на фоне ослабления иммунитета, обусловленного присутствием в организме одного штамма, происходит заражение другим штаммом возбудителя, нередко с отличным от первого спектром фенотипической лекарственной устойчивости (ЛУ) [8]. Таким образом, смешанную инфекцию следует отличать от экзогенной реинфекции – нового эпизода заражения, возникшего у излеченного пациента, и суперинфекции – заражения новым штаммом возбудителя на фоне уже имеющегося в организме, когда в результате лечения по разным причинам абациллирование не было достигнуто. Показано, что риск повторного эпизода, возникшего после проведенного лечения, в 4–7 раз выше, чем при первичном инфицировании [4]. Клинически случаи повторного заражения могут протекать в форме обострений или рецидивов ТБ, требующих хирургического лечения в случае множественной/широкой лекарственной устойчивости (МЛУ/ШЛУ) возбудителя [9, 10]. Показано, что рецидив ТБ с МЛУ возбудителя (МЛУ-ТБ) у больных, завершивших курс лечения, в 5,2% случаев возникает в течение двухлетнего периода наблюдения [11].
 В этой связи возникает вопрос об интерпретации результатов теста фенотипической лекарственной чувствительности (ЛЧ), особенно при выделении от больного и чувствительного, и мультирезистентного к ПТП изолятов возбудителя. Так, в обзоре N. Walter и соавт. [8] приведены примеры ошибочной трактовки появления МЛУ как результата амплификации резистентности M. tuberculosis при терапии препаратами 1-го ряда в течение нескольких месяцев. С другой стороны, свежее заражение чувствительным штаммом может совпасть по времени или спровоцировать реактивацию латентной инфекции, обусловленной МЛУ штаммов возбудителя [12, 13]. Таким образом, инфицирование несколькими штаммами возбудителя одновременно или в течение нескольких эпизодов заражения осложняет эпидемиологический анализ, лабораторную диагностику и лечение больных МЛУ-ТБ.
В этой связи возникает вопрос об интерпретации результатов теста фенотипической лекарственной чувствительности (ЛЧ), особенно при выделении от больного и чувствительного, и мультирезистентного к ПТП изолятов возбудителя. Так, в обзоре N. Walter и соавт. [8] приведены примеры ошибочной трактовки появления МЛУ как результата амплификации резистентности M. tuberculosis при терапии препаратами 1-го ряда в течение нескольких месяцев. С другой стороны, свежее заражение чувствительным штаммом может совпасть по времени или спровоцировать реактивацию латентной инфекции, обусловленной МЛУ штаммов возбудителя [12, 13]. Таким образом, инфицирование несколькими штаммами возбудителя одновременно или в течение нескольких эпизодов заражения осложняет эпидемиологический анализ, лабораторную диагностику и лечение больных МЛУ-ТБ.
Доказательством присутствия в организме пациента нескольких штаммов M. tuberculosis служит выделение из мокроты и/или других видов исследуемого материала изолятов возбудителя с существенно различающимися профилями генотипирования [3, 4, 14, 15]. С этой целью используют метод типирования на основе ПЦР, который позволяет оценить число тандемных нуклеотидных повторов в двух или более локусах MIRU-VNTR хромосомы [3, 5, 16]. Однако «золотым стандартом» генотипирования M. tuberculosis остается трудоемкий, но и наиболее дискриминирующий в большинстве случаев метод IS6110-RFLP-типирования, основанный на сравнении числа и взаиморасположения копий мобильного элемента IS6110 в паттернах рестрикции ДНК изолятов M. tuberculosis [17, 18]. При этом необходимо учитывать, что клональная микроэволюция возбудителя в организме хозяина может обусловить аллельный полиморфизм серийных изолятов (субпопуляций) M. tuberculosis пациента, первоначально инфицированного одним штаммом. В этом случае наблюдают незначительные различия паттернов ДНК, касающиеся числа повторов в единственном локусе MIRU-VNTR и/или 1–2 копий мобильного элемента IS6110 [5, 8, 15, 17, 19].
В любом случае оценка генетической вариабельности изолятов M. tuberculosis способствует не только правильной интерпретации результатов теста ЛЧ, но и установлению эпидемиологических связей между случаями заболевания ТБ, особенно в противотуберкулезных учреждениях, где частота внутрибольничного инфицир...












