Урология №5 / 2020
Резистентность возбудителей внебольничных инфекций мочевыводящих путей: уроки российских многоцентровых микробиологических исследований. Часть II
Медицинский институт ФГАОУ ВО «Балтийский федеральный университет им. Иммануила Канта», Калининград, Россия
Выбор антимикробного препарата (АМП) для терапии инфекций мочевыводящих путей (ИМП) определяется многими факторами, однако в настоящее время в качестве одного из наиболее значимых критериев используется популяционная антибиотикорезистентность уропатогенов.
В то же время существуют случаи, когда клиническая эффективность антимикробного препарата не коррелирует с активностью in vitro, в частности, подобная дискордантность выявлена для фосфомицина трометамола. Сопоставление данных микробиологических исследований возбудителей ИМП, выполненных в разное время, представляет большой практический и научный интерес.
В то же время подобные сравнения имеют ограничения, такие как использование разных критериев интерпретации чувствительности микроорганизмов, особенности формирования исследуемой популяции пациентов, сбор штаммов на разных географических территориях. Поэтому при всей кажущейся простоте и наглядности данных по чувствительности уропатогенов их использование для обоснования рациональной антимикробной терапии связано с многочисленными нюансами, способными существенно исказить их объективную оценку. В связи с чем важным моментом является проведение не только микробиологических, но и клинических исследований для получения данных о сравнительной эффективности применяемых АМП.
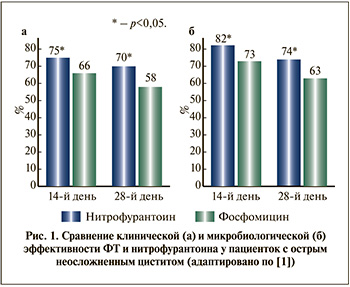 В литературе можно столкнуться с завышенной оценкой ожидаемой клинической эффективности антимикробного препарата (АМП) в случае выявления низкой устойчивости in vitro по данным микробиологических исследований. В частности, такая ситуация складывается в отношении фосфомицина трометамола (ФТ) как препарата терапии инфекций мочевыводящих путей (ИМП). Для объективной оценки возможностей использования препарата необходимо учитывать не только данные, полученные in vitro, но и результаты сравнительных клинических исследований. В связи с этим представляют интерес результаты самого крупного независимого сравнительного исследования, в котором сравнивали эффективность ФТ и нитрофурантоина в отношении 530 пациенток с острым неосложненным циститом (ОНЦ). В исследовании пациентки получали либо макрокристаллический нитрофурантоин 100 мг 3 р/сут., либо ФТ 3 г однократно [1]. Как клиническая, так и микробиологическая эффективность ФТ оказалась достоверно ниже, чем у нитрофурантоина, составив лишь 58 и 63% соответственно (рис. 1). Интересно, что увеличение длительности курса терапии ФТ не приводит к повышению клинической или микробиологической эффективности, которые после двух или трех доз ФТ, принимаемых через день, остаются на уровне 66,1 и 48,7% соответственно [2].
В литературе можно столкнуться с завышенной оценкой ожидаемой клинической эффективности антимикробного препарата (АМП) в случае выявления низкой устойчивости in vitro по данным микробиологических исследований. В частности, такая ситуация складывается в отношении фосфомицина трометамола (ФТ) как препарата терапии инфекций мочевыводящих путей (ИМП). Для объективной оценки возможностей использования препарата необходимо учитывать не только данные, полученные in vitro, но и результаты сравнительных клинических исследований. В связи с этим представляют интерес результаты самого крупного независимого сравнительного исследования, в котором сравнивали эффективность ФТ и нитрофурантоина в отношении 530 пациенток с острым неосложненным циститом (ОНЦ). В исследовании пациентки получали либо макрокристаллический нитрофурантоин 100 мг 3 р/сут., либо ФТ 3 г однократно [1]. Как клиническая, так и микробиологическая эффективность ФТ оказалась достоверно ниже, чем у нитрофурантоина, составив лишь 58 и 63% соответственно (рис. 1). Интересно, что увеличение длительности курса терапии ФТ не приводит к повышению клинической или микробиологической эффективности, которые после двух или трех доз ФТ, принимаемых через день, остаются на уровне 66,1 и 48,7% соответственно [2].
Существует несколько объяснений несоответствия между высокой активностью ФТ in vitro и относительно низкой клинической эффективностью данного АМП: 1) в настоящее время при определении чувствительности микроорганизмов к ФТ добавляется глюкозо-6-фосфат (Г6Ф), который в десятки раз снижает минимальную подавляющую концентрацию (МПК) (повышает активность по данным исследований in vitro) данного АМП [3]; 2) в некоторых исследованиях выявлена высокая вариабельность фармакокинетических показателей ФТ после приема внутрь; в частности, установлено, что концентрация свыше пограничного значения 32 мг/л в течение 48 ч отмечалась лишь у 67,8% пациентов, а в течение 72 ч – только у 30% [4]; 3) способность быстро формировать устойчивость у грамотрицательных бактерий в ходе лечения [5]; 4) наличие в клинической популяции E. coli явления гетерорезистености к ФТ, когда в популяции чувствительных к ФТ бактерий присутствуют бактерии, имеющие высокую устойчивость к ФТ, при этом наличие подобных штаммов не влияет на МПК, оцениваемую стандартными методами определения чувствительности [6].
Гипотезу о быстром формировании устойчивости в ходе терапии ФТ подтверждает исследование W. Quek et al. [7], в котором была предпринята попытка назначения ФТ пациентам с циститом в том случае, если из мочи выделяли устойчивые к цефтриаксону штаммы уропатогенов. После назначения 3 доз ФТ по 3 г через день оказалось, что микробиологическая эффективность препарата составляет всего 60%, у 28,7% пациентов развились рецидивы инфекции, а у 30% после терапии были выделены штаммы, резистентные к ФТ [7].
По данным недавно проведенного систематического обзора, фармакодинамическим условием предупреждения развития резистентности к фосфомицину считается соблюдение соотношения AUC 24 /МПК ≥3136 (см. табл. 1) [22]. Как видно из таблицы, по этому показателю фосфомицин существенно уступает другим классам антибиотиков, требуемое соотношение AUC 24/МПК может быть достигнуто только при назначении фосфомицина в дозе 2 г каждые 6 ч, т.е. при достижении суточной дозы 8 г. Такие режимы дозирования возможны только при использовании внутривенной формы препарата.

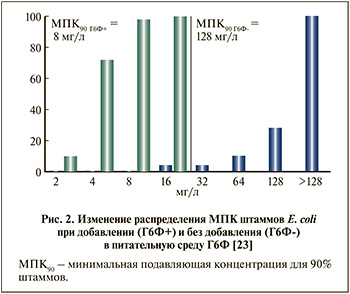 Фосфомицина трометамол был разработан в 1969 г., до середины 1970-х гг. были проведены первые исследования, которые установили умеренную активность в отношении уропатогенов, в первую очередь E. coli (МПК90 32–64 мкг/мл) [8...
Фосфомицина трометамол был разработан в 1969 г., до середины 1970-х гг. были проведены первые исследования, которые установили умеренную активность в отношении уропатогенов, в первую очередь E. coli (МПК90 32–64 мкг/мл) [8...












