Фарматека №13 / 2021
Роль дефицита магния в патогенезе недифференцированной дисплазии соединительной ткани
Уральский государственный медицинский университет, кафедра фармакологии и клинической фармакологии, Екатеринбург, Россия
Магний является вторым по распространенности внутриклеточным катионом и играет важнейшую роль в реализации клеточных функций. Все большее значение придается влиянию дефицита магния на строение и механический гомеостаз соединительной ткани (СТ). Недостаточность магния обусловливает развитие ряда состояний, одно из наиболее распространенных – недифференцированная дисплазия СТ. В настоящем обзоре освещены современные подходы к оценке взаимосвязи дефицита магния и развития патологии СТ. Ионы Mg2+ участвуют в стабилизации вторичной и третичной структур нуклеиновых кислот, образуя катионные «мостики» между отрицательно заряженными фосфатными группами. Магний участвует в регуляции баланса образования, деградации фибриллярных и нефибриллярных компонентов межклеточного матрикса путем снижения экспрессии генов матриксных металлопротеиназ и стимуляции синтеза коллагена и аггрекана. Магний усиливает митотическую активность клеток СТ путем повышения процессов синтеза белков и запуска сигнальных путей, связанных с мишенью рапамицина млекопитающих. Ионы Mg2+ способствуют переводу интегринов фибробластов в высокоаффинную форму, позволяя им связываться с коллагеном, тем самым повышая стабильность и целостность ткани. Дефицит магния ассоциирован с повышением активности матриксных металлопротеиназ, являющейся ключевым фактором деградации СТ. Недостаток магния приводит к накоплению дефектного коллагена, снижению синтеза структурных и сигнальных белков, нуклеиновых кислот, подавлению митотической активности клеток. Возникающее в условиях дефицита магния снижение аффинности интегринов фибробластов к коллагену приводит к дезорганизации ткани. Таким образом, дефицит магния ассоциируется с нарушением функционирования клеток и целостности внеклеточного матрикса СТ.
Введение
Наследственные нарушения соединительной ткани (ННСТ) – спектр состояний, обусловленных генетически детерминированными аномалиями коллагена, фибриллина и других матриксных белков [1]. Клиническая картина обсуждаемых состояний неоднородна и значительно варьируется от минимальных особенностей развития опорно-двигательного аппарата, кожных, глазных или висцеральных проявлений до угрожающих жизни сердечно-сосудистых событий [2].
Особенностью недифференцированной дисплазии СТ (НДСТ) является отсутствие явного генетического дефекта с определенным типом наследования и, видимо, несколько меньшая степень риска сосудистых катастроф [3]. В действующих федеральных клинических рекомендациях по лечению пациентов с дисплазиями СТ среди медикаментозных средств ключевое место занимают препараты магния [4].
Магний – четвертый по содержанию в организме и второй по внутриклеточной концентрации катионом [3–5]. Ионы Mg2+ играют важнейшую роль в реализации таких клеточных функций, как интегрин-ассоциированная адгезия клеток на различных макромолекулярных субстратах, миграция клеток, транскрипция ДНК, синтез белка, обеспечивающих механический гомеостаз соединительной ткани [6]. Более глубокое понимание роли магния в патогенезе НДСТ и профилактике ее осложнений позволит персонифицировать походы к ведению лиц с обсуждаемой патологией.
Цель исследования: охарактеризовать современное понимание роли дефицита магния в патогенезе НДСТ.
Физиологическая роль магния в СТ
Магний участвует в поддержании нормального метаболизма и механического гомеостаза СТ.
Ионы Mg2+ стабилизируют вторичную и третичную структуры дезоксирибонуклеиновой и рибонуклеиновой кислот (ДНК и РНК), формируя катионные «мостики» между отрицательно заряженными фосфатными группами (рис. 1) [7]. Катион Mg2+ имеет решающее значение в поддержании конформации транспортной РНК, псевдоузлов РНК, элементов третичной структуры рибосомальной РНК, РНК-трансфер-мессенджера и каталитической самосплайсирующейся РНК (рис. 1) [7].
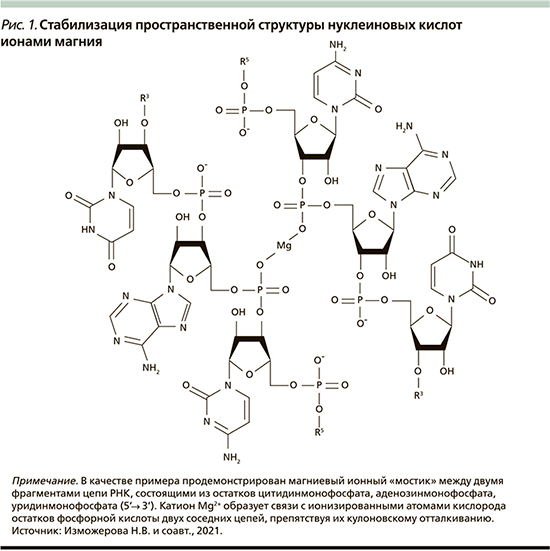
Магний оказывает влияние на фибриллярные компоненты (коллагеновые и эластические волокна) и нефибриллярные структурные элементы внеклеточного матрикса. Баланс между синтезом и деградацией этих структурных компонентов клетки определяет состояние цитоскелета клетки и его целостность.
Ремоделирование, деградация и протеолиз коллагеновых волокон внеклеточного матрикса обеспечиваются активностью матриксных металлопротеиназ (MMP) [8]. Эта группа металлоферментов имеет цинк-связывающий домен и включает коллагеназы-1, -2 и -3 (классифицируемые соответственно как ММР-1, -8, -13), расщепляющие фибриллярный коллаген типов I, II и III; желатиназы (ММР-2 и -9), разрушающие как коллаген-базальные мембраны, так и фибронектин; стромелизины (ММР-3, -10 и -11), действующие на различные компоненты внеклеточного матрикса, в т.ч. протеогликаны, ламинин, фибронектин и аморфные коллагены; а также семейство мембраносвязанных ММР ADAM (a disintegrin and metalloprotease), иначе именуемые адамазинами [9].
ММР продуцируются фиброблас-тами, макрофагами, нейтрофилами, синовиальными и некоторыми эпителиальными клетками. Секреция ММР индуцируется факторами роста (тромбоцитарный фактор роста [Platelet-derived growth factor – PDGF], факторы роста фибробластов [Fibroblast growth factor – FGF]), цитокинами (интерлейкин-1 (IL-1), фактором некроза опухоли (Tumor necrosis factor – TNF-α), фагоцитозом в макрофагах, а тормозится TGF-β и глюкортикоидами (рис. 2) [10].
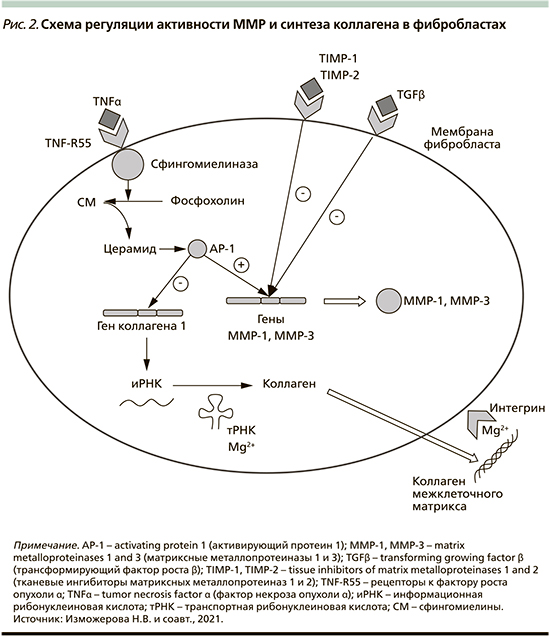
TNF-α также стимулирует деградацию внеклеточного матрикса, индуцируя экспрессию фибробластами MMP-1 ...












