Клиническая Нефрология №4 / 2013
Роль матриксных металлопротеиназ в прогрессировании наследственных заболеваний почек (Обзор литературы)
ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России
Настоящий обзор посвящен роли матриксных металлопротеиназ при наследственных почечных заболеваниях: синдроме Альпорта и кистозах почек.
Семейство матриксных металлопротеиназ
Матриксные металлопротеиназы (MMП) представляют собой семейство структурно связанных протеолитических ферментов, содержащих ион Zn2+ в активном центре. ММП секретируются разными клетками (фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы, хондроциты, остеобласты и др.) и гидролизируют все компоненты экстрацеллюлярного матрикса (ЭЦМ): все коллагены и проколлагены, протеогликаны, эластин, фибронектин, ламинин, а также адгезивные и другие белки соединительной ткани [1, 2].
ММП играют важную роль во многих физиологических процессах, таких как эмбриональное развитие, морфогенез, репродукция и ремоделирование ткани, а также в различных патологических процессах. Изменение активности ММП (как увеличение, так и снижение) сопутствует многим заболеваниям человека (опухоли, фиброзирующие заболевания сердца, легких, печени и почек, артрит, язвенная болезнь желудка и т. д.).
Общая характеристика ММП и их ингибиторов
Большинство ММП секретируются как латентные проферменты. Отдельные представители ММП, связанные с клеточной мембраной, известные как ММП мембранного типа (МТ-МПП), секретируются в функционально активной форме [3]. Активация латентных про-МПП осуществляется под действием плазмина или других ММП [4–6].
В структуре всех ММП выделяют сигнальный пептид, необходимый для успешной секреции из клетки; пропептидный участок, при отщеплении которого ММП активируются; каталитический домен, имеющий координационные связи с катионом цинка каталитического центра, и шарнирный регион. Каталитический домен включает два иона Zn2+ и три иона Са2+. Все ферменты, кроме ММП-7, имеют концевой гемопексиноподобный домен, содержащий центр связывания субстрата. В ММП-2, -9 выявлен дополнительный участок включения в каталитическом домене, схожий с фибронектином 2-го типа, который, по-видимому, обеспечивает высокое сродство желатиназ к мембранным компонентам [6]. Пропептид содержит пептидную последовательность PRCGV/NPD, получившую название «цистеиновый выключатель», поскольку содержит SH-группу, которая, связываясь с атомом Zn2+ в активном центре, поддерживает молекулу ММП в форме зимогена (предшественника ММП неактивной формы). После гидролитического удаления пропептида и освобождения Zn2+-связывающего центра происходит активация ММП.
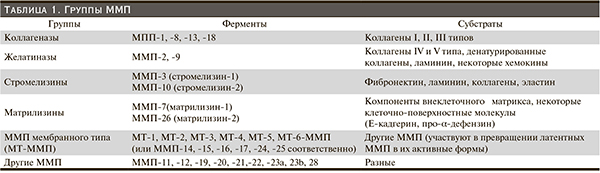
В настоящее время известно более 30 ММП, объединенных в 6 различных групп (табл. 1).
ММП различаются между собой по молекулярной структуре, субстратной специфичности и распределению в тканях. Наиболее изучены ферменты группы желатиназ – ММП-2 и ММП-9. Именно этим ферментам принадлежит ведущая роль в расщеплении коллагена IV типа, ламинина, некоторых хемокинов. ММП из группы коллагеназ участвуют в деградации коллагенов I, II, III типов. ММП мембранного типа являются рецепторами и активаторами других ММП и обеспечивают протеолиз в околоклеточном пространстве. Группа «других» ММП включает разные пептидазы, которые секретируются единичными типами клеток или экспрессируются в особых ситуациях [4, 7].
Основная биологическая функция ММП заключается в удалении компонентов внеклеточного матрикса. Металлопротеазы регулируют действие ростовых факторов: сосудистого эндотелиального фактора роста, рецептора фактора роста фибробластов, эпителиального фактора роста и инсулиноподобного фактора роста [8]. ММП-2, -3, -7, -9 способствуют активации трансформирующего фактора роста β, являющегося хемоатрактантом для моноцитов, высвобождая его из матрикса [9]. Отщепление CD44, опосредованное МТ1-ММП, ассоциировано с клеточной миграцией. Под воздействием протеолиза ММП некоторые компоненты внеклеточного матрикса начинают демонстрировать скрытые биологические функции: так, деградация коллагена 1-го типа коллагеназами ассоциирована с активизацией остеокластов [10].
Металлопротеиназы продуцируются нормальными или трансформированными клетками: нейтрофилами, моноцитами, макрофагами, фибробластами, остеокластами, хондроцитами, кератиноцитами, эндотелиальными и эпителиальными клетками [11].
Активность ферментов зависит от уровня экспрессии их генов и от наличия активаторов и ингибиторов. Экспрессия ММП сходна с экспрессией белков острой фазы. Транскрипцию и экспрессию ММП индуцируют интерлейкин-1, тромбоцитарный эндотелиальный фактор роста, эпидермальный фактор роста, фактор роста фибробластов, фактор роста гепатоцитов, фактор некроза опухоли-α, подавляет эти процессы трансформирующий фактор роста -β1 [1, 9, 12–14].
Регуляция активности ферментов на посттрансляционном уровне осуществляется активацией зимогенов или взаимодействием с тканевыми ингибиторами ММП (ТИММП) [6]. Предшественники ММП активируются в межклеточной среде преимущественно плазмином и другими протеиназами, в т. ч. и ММП, а также тиолмодифицирующими агентами ...