Терапия №8 / 2021
Синдекан-1 и сердечно-сосудистые заболевания
1) ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва;
2) ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения г. Москвы;
3) ФГАОУ ВО «Первый московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет);
4) ФКУ «Главное бюро медико-социальной экспертизы по Кабардино-Балкарской Республике» Министерства труда и социальной защиты России, г. Нальчик
Аннотация. На сегодняшний день остается актуальным поиск и изучение новых биомаркеров, способных помогать в диагностике сердечно-сосудистых заболеваний, служить инструментом оценки эффективности терапии, прогностическим критерием клинических исходов и показателем в стратификации риска. В представленном литературном обзоре рассмотрены патофизиологические аспекты представителя трансмембранных протеогликанов синдекана-1 (SDC-1), многие из которых окончательно не ясны. Появляется все больше публикаций, демонстрирующих важность определения SDC-1 в качестве нового биологического маркера для диагностики и оценки прогноза у больных кардиологического профиля.
ВВЕДЕНИЕ
Синдеканы представляют собой трансмембранные протеогликаны (PG), состоящие из основного белка, к которому присоединены боковые цепи гликозаминогликана (GAG), связывающего фактор роста [1]. Семейство синдеканов состоит из четырех подтипов [2]. Синдекан-1 (SDC-1), известный также как CD 138, в основном обнаруживается в эпителиальных клетках, синдекан-2 (SDC-2) присутствует в клетках мезенхимального происхождения, синдекан-3 (SDC-3) – только в нейрональной ткани и хряще, а синдекан-4 (SDC- 4) экспрессируется повсеместно [3]. SDC-1 содержит 288 аминокислот, молекулярная масса белковой части составляет 32,5 кДа [4].
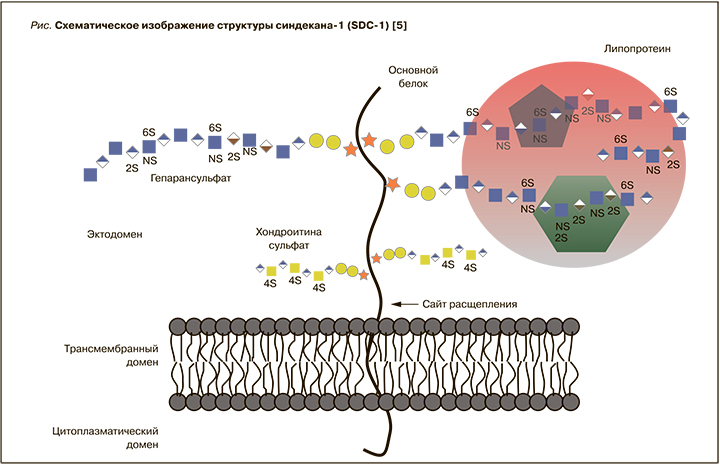
Белковые ядра синдеканов состоят из C-концевого цитоплазматического домена, трансмембранного домена и большого N-концевого внеклеточного домена [5]. Внеклеточный домен – наиболее вариабельная часть белка, сходство последовательностей между синдеканами составляет менее 20%. Эктодомен содержит порядка пяти цепей GAG; природа, количество и положение цепей GAG на коровом белке синдеканов неизменны у разных видов. SDC-1 в различных тканях содержит разные типы GAG, включая гепарансульфат (HS) и хондроитин сульфат (CS) различной длины и ультраструктуры (рис.) [5]. Биохимические реакции, изменяющие структуру HS, принимают участие в регулировании связывания белков PG [6, 7]. Биологическая роль SDC-1 определяется его способностью связывать множество лигандов, кроме того, доказано его участие в матричных взаимодействиях и в матричной сборке [7].
Как известно, компоненты внеклеточного матрикса, особенно PG, связаны с воспалением, фиброзом и ремоделированием сердца [7]. Было обнаружено, что члены семейства синдеканов связаны с ранними стадиями фиброза, выступая в качестве важной мишени для трансформации фактора роста-β2 (TGFβ2) [8]. Экспрессия синдекана повышается в ответ на провоспалительные стимулы при различных сердечных заболеваниях, сопровождающихся формированием фиброза [9]. На моделях мышей, лишенных SDC-1 и SDC- 4, показана сниженная активация профиброзной передачи сигналов и увеличение выраженности разрыва сердца при инфаркте миокарда (ИМ), что указывает на важную роль этих молекул [7]. В то время как так называемый короткий цитоплазматический хвост синдеканов регулирует передачу сигналов, их внеклеточная часть, замещенная гепарансульфатными гликозаминогликановыми цепями, связывает множество молекул внеклеточного матрикса (ЕСМ), участвующих в фиброзе (коллагены, факторы роста, цитокины и белки адгезии иммунных клеток) [7]. Полноразмерные синдеканы индуцируют профиброзную передачу сигналов, повышая экспрессию коллагенов, факторов дифференцировки миофибробластов, ферментов ЕСМ, факторов роста и молекул адгезии иммунных клеток, тем самым усиливая жесткость сердца и предотвращая разрыв миокарда. Под воздействием провоспалительных стимулов синдекановые эктодомены ферментативно высвобождаются из кардиальных клеток («отторжение» синдекана). Эктодомены влияют на экспрессию молекул ECM, способствуя их деградации и разрыву сердца при ИМ [7].
СИНДЕКАН-1: СИСТЕМА РЕНИН–АНГИОТЕНЗИН–АЛЬДОСТЕРОН
Профибротическая роль ангиотензина II (Ang II) в ремоделировании сердца – хорошо известный процесс, опосредованный сопутствующей активацией TGFβ1 и фактора роста соединительной ткани (CTGF) посредством передачи клеточных сигналов, что приводит к усиленному синтезу коллагена и других множественных матричных белков [10, 11]. Принимая участие в этих структурных изменениях, Ang II вызывает гипертрофию и фиброз миокарда. Подобно синдеканам, Ang II-опосредованная передача сигналов происходит в основном через цепи HS благодаря их способности связываться с ECM. Эта связь также стимулирует выработку не только факторов роста, но и их рецепторов, таких как эндоглин, рецептор TGFβ1. Блокада данного сигнального пути способствует уменьшению индуцированного Ang II миокардиального фиброза [7].
Данные работы Schellings M. et al. [12] продемонстрировали участие SDC-1 в ремоделировании сердца путем воздействия на передачу сигналов, опосредованную факторами роста. Отсутствие SDC-1 у экспериментальных мышей защищает их от индуцированной Ang II сердечной дисфункции и последующего фиброза, поскольку потеря SDC-1 ослабляет эффект Ang II за счет снижения индукции факторов роста (CTGF, TGFβ1) [7, 12]. Эти данные подтверждаются значительным увеличением экспрессии SDC-1 у мышей, получавших Ang II. Те же авторы идентифицировали повышенную экспрессию in vivo коллагена I и III и CTGF в фибробластах мышей после инфузии Ang II.
Другой важный аспект представлен участием цепей HS в передаче фиброгенного сигнала. Добавление протамина (ингибитор гепарина и HS) предотвращало увеличение экспрессии CTGF и коллагена I после стимуляции Ang II. Кроме того, сердечные фибробласты, обработанные эктодоменом SDC-1, без цепей HS не влияли на экспрессию CTGF, дополнительно подтверждая, что HS участвуют в передаче фиброгенного сигнала SDC-1 [12, 13].
СИНДЕКАН-1 ПРИ АТЕРОСКЛЕРОЗЕ
В нескольких исследованиях оценивалась экспр...












