Эпидемиология и Инфекционные болезни. Актуальные вопросы №5 / 2017
Современные возможности и перспективы повторного лечения больных хроническим гепатитом С
1 ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва, Россия;
2 ГБУЗ «Московский клинический научно-практический центр имени А.С. Логинова» Департамента здравоохранения города Москвы, Москва, Россия
В статье изложены современные представления об основных факторах, влияющих на успешность лечения больных хроническим гепатитом С. Приведены собственные данные по ключевым показателям, ассоциированным с неэффективностью противовирусной терапии. Проанализированы литературные источники, содержащие результаты клинических исследований разных схем терапии. Обсуждаются возможности, проблемы и перспективы современных вариантов повторного лечения пациентов, не ответивших на первичный курс противовирусной терапии.
Противовирусная терапия (ПВТ) хронического гепатита С (ХГС) за время своего существования претерпела значительную эволюцию (рис. 1). Более двух десятилетий практически безальтернативной схемой лечения являлась комбинация препаратов интерферона-α (стандартного или пегилированного – ПегИФН) с рибавирином (RBV). Действуя преимущественно через иммунную систему организма больного, такой вариант терапии сопровождался широким спектром и высокой частотой развития нежелательных явлений (НЯ), демонстрируя при этом довольно низкую эффективность.
Принципиально иным подходом в ПВТ явилось создание препаратов прямого противовирусного действия (ПППД), непосредственно влияющих на белки вируса гепатита С (ВГС). В соответствии с белком ВГС, служащим мишенью для ПППД, выделяют 3 основных класса таких препаратов: ингибиторы NS3/4A-протеазы, ингибиторы NS5B-полимеразы и ингибиторы NS5A-белка репликативного комплекса.
В 2011 г. появились трехкомпонентные схемы ПВТ, представляющие собой сочетание ПегИФН и RBV с ПППД. Такой подход позволил повысить эффективность лечения, но сделал терапию еще менее безопасной. Широта спектра и частота развития НЯ ПВТ при применении трехкомпонентных схем (особенно, включавших ингибиторы вирусной протеазы первой волны) достигли в этот момент своего пика. Появление ингибиторов протеазы второй волны улучшило ситуацию с эффективностью и безопасностью терапии.
В 2013 г. в подходах к лечению ХГС произошли революционные изменения. Появились существенно более безопасные схемы терапии, в которых препарат ИФН-α уже не являлся обязательным компонентом. Довольно быстро после начала применения безинтерфероновых вариантов ПВТ стало ясно, что монотерапия ПППД (даже с очень хорошими характеристиками) не позволяет достигать желаемых результатов, и для обеспечения максимальной эффективности лечения необходимо комбинирование ПППД (для одновременного воздействия на несколько белков вируса).
Современная терапия ХГС представляет собой сочетанное применение нескольких ПППД с добавлением (в некоторых случаях) RBV.
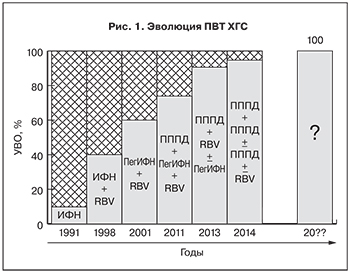 Несмотря на неуклонный рост эффективности ПВТ и приближение ее к абсолютным показателям, продолжает накапливаться пул больных ХГС, не достигших устойчивого вирусологического ответа (УВО) после курса лечения (см. рис. 1). Такие пациенты, безусловно, относятся к категории «сложных» и требуют к себе особого, сугубо индивидуализированного подхода. Только детальное изучение причин неэффективности проведенного лечения, уточнение индивидуальных характеристик пациента и некоторых особенностей вируса позволяют разработать оптимальную стратегию для «перелечивания» конкретного больного ХГС, имеющего неудачный опыт предыдущей ПВТ.
Несмотря на неуклонный рост эффективности ПВТ и приближение ее к абсолютным показателям, продолжает накапливаться пул больных ХГС, не достигших устойчивого вирусологического ответа (УВО) после курса лечения (см. рис. 1). Такие пациенты, безусловно, относятся к категории «сложных» и требуют к себе особого, сугубо индивидуализированного подхода. Только детальное изучение причин неэффективности проведенного лечения, уточнение индивидуальных характеристик пациента и некоторых особенностей вируса позволяют разработать оптимальную стратегию для «перелечивания» конкретного больного ХГС, имеющего неудачный опыт предыдущей ПВТ.
Ключевые факторы неэффективности ПВТ
Всех больных ХГС, имеющих неудачный опыт ПВТ, очевидно, можно условно разделить на 3 группы:
- Безуспешно леченные (ПегИФН с RBV).
- Не ответившие на трехкомпонентную терапию (ПегИФН, RBV и ПППД).
- Не достигшие УВО после безинтерферонового курса лечения (одного или нескольких ПППД в сочетании с RBV или без него).
Основным фактором, ассоциированным с низкой эффективностью терапии на основе ПегИФН, является недостаточная чувствительность пациента к действию ИФН-α. Именно эта почти не модифицируемая особенность организма является залогом неудачи первичного курса лечения у двух первых групп больных ХГС с неудачным опытом ПВТ в анамнезе.
У пациентов, не достигших УВО после безинтерферонового курса лечения, главной причиной неудачи является наличие у ВГС клинически значимой устойчивости (резистентности) к применяемым ПППД.
В организме больного обычно существует гетерогенная популяция вируса (в том числе различные резистентные варианты). Очень высокая репликативная активность ВГС, характеризующаяся появлением > 1012 новых вирусных частиц в день, сопряжена с высокой частотой образования вариантов вируса, имеющих определенные точечные аминокислотные замены, обусловливающие лекарственную устойчивость. Резистентные варианты ВГС, имеющие одну или несколько мутаций устойчивости, появляются постоянно в большом количестве. Ежедневно воспроизводится почти 1011 вирусов с единичными и > 109 – с двойными мутациями. Некоторые из этих вариантов ВГС нежизнеспособны и самостоятельно элиминируются, другие могут длительно персистировать, сохраняя резистентные свойства [1].
Описано значительное количество аминокислотных замен в регионах NS3/4A-протеазы, NS5B-полимеразы и в NS5A-белка репликативного комплекса ВГС, которые формируют мутации в указанных сегментах вирусного генома. Основные (первичные) мутации приводят к нарушению связывания ПППД с каталитическим центром соответствующего фермента и, как следствие, ослаблению ингибирующего влияния препарата на репликацию вируса.
 При терапии ПППД вирусная нагрузка вначале быстро, а затем плавно снижается за счет эффективного подавления чувст...
При терапии ПППД вирусная нагрузка вначале быстро, а затем плавно снижается за счет эффективного подавления чувст...












