Фарматека №6-7 / 2023
Анемия у взрослых онкологических пациентов
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Анемия является частым осложнением злокачественного процесса, негативно влияя на качество жизни пациента, а также на результаты противоопухолевого лечения и прогноз заболевания в целом. Патогенез анемии при злокачественном процессе достаточно сложен и обусловлен как наличием самой опухоли, так и проводимым противоопухолевым лечением. В настоящем обзоре обобщены современные представления о причинах и механизмах развития анемии у онкологических пациентов, изложены алгоритм диагностики и ключевые методы коррекции данного состояния.
Эпидемиология
Анемия является одним из широко распространенных и потенциально опасных состояний у онкологических пациентов, негативно отражаясь на качестве и продолжительности их жизни. На момент постановки диагноза анемия той или иной степени тяжести диагностируется почти у каждого третьего пациента, нередко являясь одним из первых и основных клинических симптомов заболевания [1]. По другим данным, ее распространенность может достигать 90% и зависит главным образом от локализации первичной опухоли, стадии заболевания и метода противоопу-
холевого лечения [1, 2]. Пониженный уровень гемоглобина (Hb) чаще всего выявляется у пациентов с онкогематологическими заболеваниями, такими как лимфома и множественная миелома, а также с сóлидными новообразованиями, затрагивающими органы женской репродуктивной системы, желудочно-кишечного тракта (ЖКТ) и легкие [1]. Риски повышаются на поздних стадиях заболевания, а также при применении цитостатической терапии и/или лучевой терапии [1, 3].
Патогенез развития анемии при злокачественных новообразованиях
К потенциальным механизмам развития анемии у онкологического, как и любого другого пациента, относятся [4]:
- • острая или хроническая кровопотеря (постгеморрагические анемии);
- • нарушение эритропоэза (гипопролиферативные анемии);
- • ускоренный гемолиз (гемолитические анемии).
Вышеописанные механизмы могут быть вызваны различными причинами, однако зачастую анемия у онкологического пациента имеет смешанный генез (см. рисунок) [2, 5].
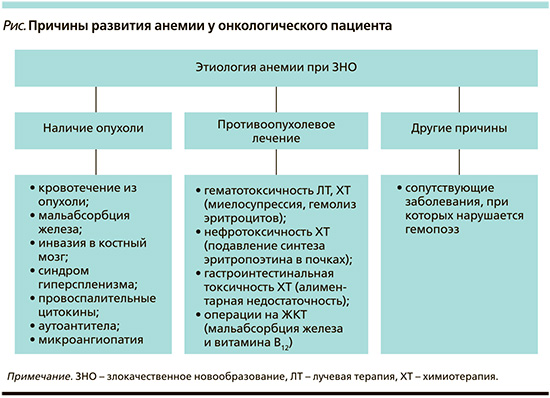
Анемия, связанная с наличием опухоли
При опухолях, локализующихся в полых органах, или при распадающемся процессе, часто происходит явное или скрытое (оккультное) кровотечение в ложе опухоли, что приводит к хронической постгеморрагической анемии [6]. Острые постгеморрагические анемии встречаются реже и наблюдаются в случае прорастания опухолевого конгломерата в крупный кровеносный сосуд или при спонтанном разрыве опухоли, что нередко бывает при гепатоцеллюлярном раке. И в том, и в другом случае всегда возникает дефицит железа, однако иногда причиной истощения запасов железа является нарушение его всасывания [7, 8]. Мальабсорбцию железа следует рассматривать у пациентов с дефицитом железа, которые не отвечают на лечение пероральными препаратами железа и/или в случае локализации опухоли в желудке, двенадцатиперстной или верхней части тощей кишки, т.е. в участках максимального всасывания железа [6].
Анемия может быть связана непосредственно с инфильтрацией опухолевых клеток (первичных или вторичных) в костный мозг. Из-за замещения нормальной кроветворной ткани костного мозга атипичными клетками и фиброзной тканью происходит угнетение гемопоэза с последующим снижением клеточности костного мозга и возможным развитием апластической анемии [7].
Иной патогенез наблюдается у пациентов с опухолями, сопровождающимися синдромом гиперспленизма и увеличением селезенки (например, при миело-, лимфопролиферативных заболеваниях, гепатоцеллюлярном раке) [9]. В данной ситуации из-за усиления фильтрующей способности селезенки происходит более быстрое разрушение эритроцитов, а зачастую и других ростков кроветворения. Содержание форменных элементов в периферической крови снижается, в то время как в костном мозге возникает компенсаторная гиперплазия с преобладанием незрелых предшественников эритроцитов и тромбоцитов.
Опухоль может также оказывать опосредованный эффект на систему кроветворения с помощью вырабатываемых в ответ провоспалительных цитокинов, подобно другим анемиям хронических заболеваний [10, 11]. Интенсивное взаимодействие между популяцией опухолевых клеток и иммунной системой приводит к продукции и высвобождению ряда цитокинов, таких как фактор некроза опухоли α (ФНО-α), интерфероны (ИФН-β, ИФН-ɣ), интерлейкины (ИЛ-1, -6) и другие хемокины [10, 11]. Как следствие – происходит повышение продукции в печени гормона гепсидина, являющегося центральным регулятором метаболизма железа [12]. Гепсидин относится к белкам острой фазы, поэтому его концентрация значительно возрастает при активном опухолевом процессе и воспалении. Связываясь с единственно известным белком – экспортером железа, ферропортином, он подавляет действие последнего. В ответ происходит ограничение абсорбции железа энтероцитами и блокирование его высвобождения в системный кровоток из клеток ретикулоэндотелиальной системы (макрофагов и гепатоцитов). Таким образом возникает функциональный (относительный) дефицит железа – состояние, при котором, запасы железа есть, но его недостаточно для нормального эритропоэза [12]. Прогрессирующее нарушение выхода железа из депо приводит к полному истощению запасов данного микроэлемента в организме – иными словами, развивается абсолютный дефицит железа (т.е. классическая железодефицитная анемия).
ФНО-α и ИЛ-1 также оказывают прямое ингиб...












