Урология №3 / 2018
Частота выявляемости и резистентность основных нозокомиальных уропатогенов в моче урологических больных в Ивановском регионе
Кафедра факультетской хирургии и урологии (зав. – д.м.н., проф. А. И. Стрельников) ФГБОУ ВО ИвГМА МЗ России, Иваново, Россия
Цель исследования: уточнить этиологию нозокомиальных ИМП, встречающихся в урологических отделениях и поликлинике ОБУЗ «Ивановская областная клиническая больница» (ИвОКБ), сформулировать рекомендации по эмпирическому назначению антибактериальных препаратов.
Материалы и методы. Выполнен мониторинг бактериального пейзажа мочи у пациентов урологического профиля с 1999 по 2015 г., определена чувствительность возбудителей к основным антибактериальным препаратам с помощью диско-диффузионного метода по Keurby–Bauer.
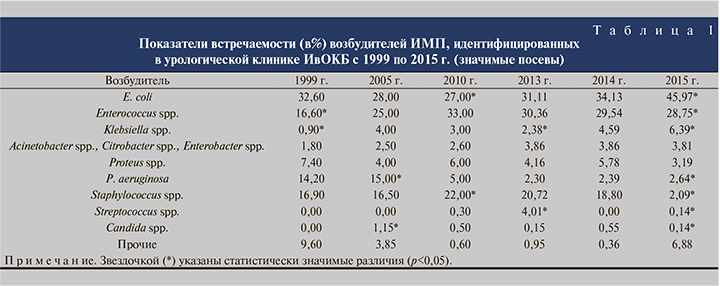
Результаты. Установлена частота выявляемости возбудителей осложненных урологических инфекций у взрослых и детей, зависимость спектра возбудителей от возраста пациента; выявлены наиболее эффективные антибактериальные препараты для больных нозокомиальными ИМП в Ивановском регионе. Выявлена высокая резистентность штаммов E. сoli к фторхинолонам, налидиксовой кислоте и нитрофуранам, в 3 раза превышающая резистентность к цефалоспоринам.
Заключение. Необходимо резко сократить эмпирическое использование фторхинолонов, препаратов налидиксовой кислоты, нитрофуранов и полностью исключить использование ампициллина в отношении больных нозокомиальными ИМП в Ивановском регионе. С целью снижения частоты нозокомиальных инфекций после выписки пациента из стационара использовать в эмпирической терапии цефалоспорины III поколения.
Введение. Исследования последних лет показывают, что наиболее проблемными являются нозокомиальные инфекции мочевыводящих путей (ИМП) [1–4]. С каждым годом увеличивается резистентность штаммов микроорганизмов у мужчин и женщин всех возрастов, что отражено в работах последних лет, выполненных в разных регионах мира [1–4]. На сегодняшний день практически не осталось ни одного антибиотика, к которому были бы чувствительны все внутрибольничные инфекции. Данная проблема обусловливает необходимость индивидуального подхода к подбору антибиотикотерапии не только для каждого региона, но и для каждого пациента в отдельности. Проблема эффективной профилактики и лечения ИМП как в амбулаторной, так и в стационарной практике до сих пор остается актуальной в связи со сложным патогенезом заболевания, неуклонным ростом числа резистентных штаммов микроорганизмов, имеющейся тенденцией к развитию тяжелых гнойно-септических осложнений и сепсиса у урологических больных [1–6]. Большинство эмпирически используемых в настоящее время антибиотиков нельзя назвать эффективными в лечении ИМП, так как часто в популяции персистируют резистентные штаммы микроорганизмов. Это объясняет не только медицинскую, но и социально-экономическую значимость проблемы, что требует использования современных высокоэффективных и дорогостоящих препаратов [5–8]. Исследования последних лет, проведенные в России, выявили высокую устойчивость E. сoli к ранним пенициллинам и ко-тримаксозолу, низкую резистентность к фторхинолонам, нитрофуранам и цефалоспоринам [4, 8, 9]. Резистентность микроорганизмов, вызывающих ИМП, требует постоянного мониторинга, поскольку различается в разных регионах мира [1–6, 9–13]. У пациентов с осложненными ИМП частота выделения резистентных штаммов выше, чем у пациентов с неосложненными ИМП, также имеются и географические различия [1–3, 7, 10–13].
Целью данного исследования было уточнить этиологию нозокомиальных ИМП, встречающихся в урологических отделениях и поликлинике ОБУЗ «Ивановская областная клиническая больница» (ИвОКБ), сформулировать рекомендации по эмпирическому назначению антибактериальных препаратов.
Материалы и методы. Проведено бактериологическое исследование мочи пациентов, получавших лечение в связи с ИМП в детском, взрослом урологических отделениях и в поликлинике ИвОКБ. Материалом исследования служила средняя порция утренней свободно выпущенной мочи, полученная после туалета наружных половых органов, либо моча, собранная катетером. Мочу собирали в стерильные одноразовые контейнеры и доставляли в бактериологическую лабораторию в течение не более 2 ч с момента забора.
Процедуру посева на питательные среды, выделение и идентификацию чистых культур, определение чувствительности микроорганизмов к антибиотикам в лаборатории ИвОКБ проводили в соответствии с регламентирующими нормативными документами по стандартным методикам [14–18]. Чувствительность бактерий к антибиотикам определяли с помощью диско-диффузионного метода по Keurby–Bauer. Метод разработан (Версия 4.0, июнь 2014 г.) на основании The European Committee on Antimicrobial Susceptibility Testing (EUCAST) по оценке антимикробной чувствительности [8, 16, 18]. Для определения чувствительности микроорганизмов использовали агар Мюллера–Хинтона и среду АГВ. Агаровая среда Мюллера–Хинтона представляет собой стандартную питательную среду, соответствующую общепринятым стандартам, предлагаемым Европейским комитетом по определению чувствительности к антимикробным препаратам EUCAST [8, 16, 18]. Агар Мюллера–Хинтона выпускается микробиологическими фирмами-производителями (ЗАО НИЦФ, Россия) в сухом виде для приготовления среды в лабораторных условиях. Питательная среда АГВ ...












