Клиническая Нефрология №2 / 2019
Эффективность и безопасность применения первого российского оригинального эритропоэз-стимулирующего препарата длительного действия в терапии анемии у пациентов с хронической почечной недостаточностью. Результаты международного многоцентрового рандомизиро
1) ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» МЗ РФ, Москва, Россия;
2) ГАУЗ «Республиканская клиническая больница» Министерства здравоохранения Республики Татарстан, Казань, Россия;
3) ООО Медицинский центр «Нефрос», Новороссийск, Россия;
4) СПбГБУЗ «Городская больница № 15», Санкт-Петербург, Россия;
5) ФГБУ ВЦЭРМ им. А.М. Никифорова МЧС России, Санкт-Петербург, Россия;
6) ГБУЗ РК «Республиканская больница им. В.А. Баранова», Петрозаводск, Россия;
7) ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии», Минск, Россия;
8) БУЗ ОО «Областная клиническая больница», Омск, Россия;
9) СПбГБУЗ «Городская больница Святой преподобномученицы Елизаветы», Санкт-Петербург, Россия;
10) ООО «Б. Браун Авитум Руссланд Клиникс», Санкт-Петербург, Россия;
11) СПбГБУЗ «Городская Мариинская больница», Санкт-Петербург, Россия;
12) СПбГБУЗ «Городская клиническая больница № 31», Санкт-Петербург, Россия;
13) Учреждение здравоохранения «4-я городская клиническая больница им. Н.Е. Савченко», Минск, Россия;
14) ООО «Купчинский центр амбулаторного диализа», Санкт-Петербург, Россия;
15) Учреждение здравоохранения «Минская ордена Трудового Красного Знамени областная клиническая больница», Минский район, агрогородок Лесной, Россия;
16) ООО «Нефролайн-Новосибирск», Новосибирск, Россия;
17) СПбГБУЗ «Николаевская больница», Санкт-Петербург, Россия;
18) ЗАО «БИОКАД», Санкт-Петербург, Россия
Цель исследования. Определить терапевтически эффективную и безопасную дозу нового оригинального эритропоэз-стимулирующего препарата BCD-131 (пегилированный дарбэпоэтин) при его многократном использовании для лечения анемии у больных хронической почечной недостаточностью (ХПН), находящихся на диализе.
Материал и методы. В международном многоцентровом рандомизированном открытом сравнительном клиническом исследовании II фазы приняли участие 75 пациентов с анемией на фоне терминальной ХПН, находившихся на диализе и регулярно получавших препараты рекомбинантного человеческого эритропоэтина. Исследование включило два этапа. На первом планировалось последовательное включение пациентов в три группы терапии исследуемым препаратом BCD-131 с эскалацией доз 1,05 мкг/кг, 1,7 мкг/кг и 2,75 мкг/кг и параллельное включение участников в группу препарата сравнения Мирцера. Препараты вводились 1 раз в месяц подкожно. В ходе первого этапа установлено, что дозы препарата BCD-131 1,05 мкг/кг и 1,7 мкг/кг обладают достаточным фармакодинамическим и клиническим эффектами, в связи с чем доза препарата BCD-131 2,75 мкг/кг не применялась в ходе дальнейшего исследования. На втором этапе первоначально включенные участники и вновь набранные пациенты (до достижения количества 25 человек в каждой из трех групп) продолжали получать терапию исследуемым препаратом BCD-131 в дозах 1,05 мкг/кг (группа 1), 1,7 мкг/кг (группа 2) и препаратом сравнения (группа 3) вплоть до 21-й недели.
Результаты. На протяжении 21 недели терапии cредний уровень гемоглобина у пациентов находился в пределах целевых значений при применении как обеих доз исследуемого препарата BCD-131, так и препарата Мирцера. Рассчитанный 95% ДИ для разницы средних арифметических значений показателя «изменение уровня гемоглобина» между группами 1 и 3 составил [-8,87; 4,47], что не превысило предустановленных границ эквивалентности 10,00 г/л и свидетельствует об эквивалентной эффективности исследуемого препарата BCD-131 в дозе 1,05 мкг/кг
и препарата сравнения Мирцера. Анализ безопасности продемонстрировал отсутствие статистически значимых различий между группами исследуемого препарата и препарата сравнения по частоте и спектру зарегистрированных нежелательных явлений, в том числе связанных с терапией, а также тромботических осложнений. Формирования связывающих антител не было обнаружено ни у одного из пациентов.
Заключение. В клиническом исследовании II фазы определена терапевтическая доза нового эритропоэз-стимулирующего препарата пегилированного дарбэпоэтина BCD-131. Продемонстрирована эквивалентная эффективность исследуемого препарата BCD-131 в дозе 1,05 мкг/кг и препарата сравнения Мирцера. Препараты BCD-131 (обе дозы) и Мирцера продемонстрировали сопоставимый благоприятный профиль безопасности, хорошую переносимость и отсутствие иммуногенности.
Введение
В настоящее время препаратом выбора для лечения анемии у пациентов с хронической почечной недостаточностью (ХПН) признаны эритропоэз-стимулирующие средства короткого и пролонгированного действий [1]. Молекула рекомбинантного человеческого эритропоэтина (рчЭПО) имеет высокое сродство к рецептору, что определяет выраженный биологический эффект in vitro [2, 3]. Однако in vivo рчЭПО быстро инактивируется печенью и элиминируется из организма, что определяет необходимость введения препарата до 3 раз в неделю [4]. Поскольку терапия аналогами эндогенного эритропоэтина проводится в течение длительного времени, а в ряде случаев пожизненно, частота выполнения инъекций определяет качество жизни пациентов и их приверженность лечению. Известно, что дополнительное гликозилирование (присоединение дополнительных углеводных цепей) молекулы эритропоэтина приводит к увеличению ее периода полувыведения и как следствие – к более продолжительному биологическому эффекту. Дарбэпоэтин альфа был создан путем присоединения двух дополнительных углеводных цепей к молекуле рчЭПО, при этом меньшее сродство новой молекулы к рецептору эритропоэтина компенсируется ее более высокой активностью и длительной циркуляцией в крови [2].
Другим способом увеличения периода полувыведения белковой молекулы служит присоединение к ней молекулы полиэтиленгликоля (ПЭГ). ПЭГ является индифферентным для организма веществом, присоединение его к рчЭПО способствует увеличению периода полувыведения, что позволяет уменьшить кратность инъекций препарата, а увеличение гидродинамического радиуса молекулы обусловливает снижение иммуногенности белка. При этом молекулярная масса ПЭГ определяет баланс фармакокинетических характеристик и активности молекулы, поскольку присоединение ПЭГ с небольшой молекулярной массой значимо не изменяет фармакокинетику молекулы, а присоединение ПЭГ со слишком большой молекулярной массой может приводить к снижению активности препарата. Оптимальной считается молекулярная масса ПЭГ около 30 кДа. В настоящее время единственным препаратом пегилированного эритропоэтина является C.E.R.A. (continuous erythropoietin receptor activator – активатор рецепторов эритропоэтина длительного действия), обладающий бόльшим по сравнению с дарбэпоэтином периодом полувыведения [5].
ЗАО «БИОКАД» разработан инновационный оригинальный препарат пегилированного дарбэпоэтина – BCD-131. Идеология создания новой молекулы включила оба описанных выше подхода: гликолизирование и пегилирование эритропоэтина [6].
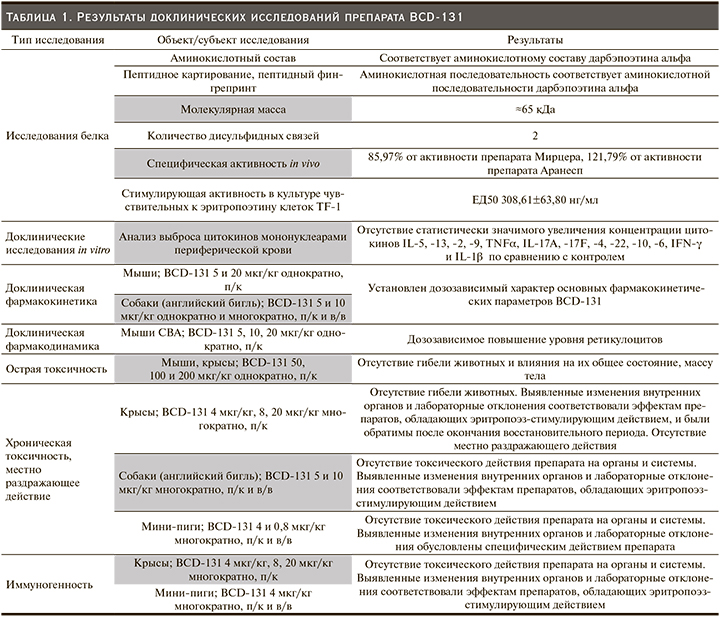
В рамках доклинических исследований детально изучены структурные, физико-химические и биологические свойства нового биотехнологического продукта. Показано, что препарат BCD-131 обладает специфической активностью in vitro и in vivo: повышает уровень гемоглобина и увеличивает количество эритроцитов в крови путем избирательного воздействия на рецепторы эритропоэтина. Результаты исследований острой и хронической токсичности продемонстрировали отсутствие гибели экспериментальных животных, значимого изменения их общего состояния, функционирования органов и систем, местно раздражающего действия и иммуногенности (табл. 1).
Первым этапом клинической разработки препарата BCD-131 стала оценка фармакокинетики, фармакодинамики, переносимости, безопасности и иммуногенности при его однократном подкожном введении в возрастающих дозах здоровым добровольцам в рамках исследования I фазы BCD-131-1 (NCT02731469). На основании полученных результатов был определен диапазон терапевтических доз исследуемого препарата BCD-131: 1,05 мкг/кг, 1,7 мкг/кг и 2,75 мкг/кг, а также подтверждена возможность его введения один раз в месяц [7].
Целью исследования II фазы BCD-131-2 (NCT03519243) стало определение терапевтически эффективной и безопасной дозы препарата BCD-131 при его многократном применении в лечении анемии у больных ХПН, находящихся на диализе. Результаты данного исследования представлены в настоящей статье.
Материалы и методы
Дизайн исследования: международное многоцентровое рандомизированное открытое сравнительное клиническое исследование.
Критерии включения. В исследовании принимали участие мужчины и женщины в возрасте от 18 до 75 лет включительно с терминальной стадией ХПН, в течение как минимум последних 3 месяцев до подписания информированного согласия (ИС), получавшие диализ (не менее 12 часов в неделю, индекс диализной дозы [Kt/v]≥1,2 для пациентов, получавших гемодиализ, и Kt/v≥1,7 для пациентов, получавших перитонеальный диализ) и препараты рчЭПО. В течение 2 недель до подписания ИС уровень гемоглобина у пациентов должен был поддерживаться в пределах целевых значений (100–120 г/л) при введении стабильной дозы рчЭПО. На скрининге коэффициент насыщения трансферрина должен был составлять 20% и более, уровень ферритина – более 100 нг/мл. В исследование не включались пациенты с анемией другой, не ...












