Акушерство и Гинекология №11 / 2019
Генетические полиморфизмы у детей, ассоциированные с развитием врожденных инфекций
1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России , Москва, Россия;
2) ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова
(Сеченовский Университет)» Минздрава России, Москва, Россия
Цель. Изучить особенности генетических полиморфизмов, определяющих реализацию и особенности течения врожденных инфекций у новорожденных с учетом их гестационного возраста.
Материалы и методы. В исследование были включены 379 новорожденных с дыхательными нарушениями различного генеза, потребовавшими проведения респираторной терапии. Все дети родились в «НМИЦ АГП им. В.И. Кулакова» Минздрава России и получали лечение в ОРИТН Центра в период с января 2013 по декабрь 2015 г. В зависимости от генеза дыхательных нарушений (инфекционный или неинфекционный) дети, вошедшие в исследование, были разделены на две основные группы: в первую группу был включен 161 ребенок с транзиторным тахипноэ новорожденных или респираторным дистресс-синдромом, во вторую – 218 детей с реализацией внутриутробной инфекции – врожденной пневмонии или раннего неонатального сепсиса. Исходя из гестационного возраста, дети двух основных групп были разделены на четыре подгруппы: 24–28 недель, 29–32 недели, 33–36 недель, 37 и более недель. Дети с выраженной задержкой внутриутробного развития и тяжелой асфиксией были исключены из исследования. У всех пациентов была взята периферическая кровь для генотипирования.
Результаты. В ходе данного исследования были выявлены статистически значимые различия между генетическими полиморфизмами у новорожденных, родившихся на различных сроках гестации, имевших инфекционную и неинфекционную причину респираторных нарушений, по распределению следующих генотипов и аллелей: на сроке 29-32 недели – NOS3-786, NOS3-894, IL1b, на сроке 33–36 нед – AGTR2, IL4R1902, IL8, GNB825, HTR2A, на сроке 37 недель гестации и более – IL8, ADD1, ADRB3.
Заключение. В результате данного исследования показано, что у новорожденных различного гестационного возраста с развитием инфекционно-воспалительных заболеваний ассоциированы разные генетические полиморфизмы, что, по-видимому, отражает процесс созревания иммунной системы. Выявлена вовлеченность в развитие инфекционных осложнений не только генов врожденного иммунитета, но и регуляторов энергетического обмена и сосудистого тонуса, что свидетельствует о сложном механизме развития септических состояний у новорожденных.
Применение высоких технологий в неонатологии привело к повышению показателей выживаемости среди недоношенных новорожденных, в особенности с очень низкой массой тела (ОНМТ) и экстремально низкой массой тела (ЭНМТ) при рождении. Наиболее частыми проявлениями различного рода патологических процессов в раннем неонатальном периоде у недоношенных детей являются дыхательные нарушения, наличие которых может свидетельствовать как о манифестации раннего неонатального сепсиса (РНС), так и о развитии врожденной пневмонии или тяжелого респираторного дистресс-синдрома (РДС). Ранняя диагностика врожденной инфекции применительно к данной категории новорожденных продолжает представлять значительные трудности как в силу неспецифического характера выявляемых у глубоконедоношенных детей клинических симптомов, быстрой скорости генерализации инфекционного процесса, так и ввиду отсутствия высокочувствительных и специфичных биологических маркеров [1]. В связи с этим изучение генетической предрасположенности к реализации врожденных инфекций у новорожденных детей может способствовать лучшему пониманию механизмов реализации патофизиологических процессов, ускорить диагностический поиск, предложить новые пути лечения, усовершенствовать меры профилактики.
Целью исследования явилось изучение генетических полиморфизмов, ассоциированных с риском заболевания и особенностями течения врожденных инфекций у новорожденных с учетом их гестационного возраста.
Материалы и методы
В исследование были включены 379 новорожденных с дыхательными нарушениями, потребовавшими проведения респираторной терапии. Все дети родились в «НМИЦ АГП им. В.И. Кулакова» Минздрава России и проходили лечение в ОРИТН в период с января 2013 по декабрь 2015 г. Критерии невключения: наличие врожденных пороков развития и выраженная задержка внутриутробного развития (масса тела при рождении менее 3-го процентиля по стандартным антропометрическим шкалам).
Родителями новорожденных было подписано добровольное информированное согласие на участие детей в исследовании. Данное исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
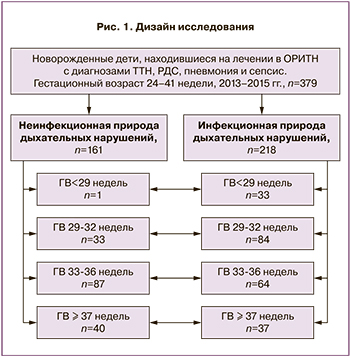 Всем новорожденным с целью диагностики врожденной инфекции проводилось клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса, контроль уровня белков острой фазы воспаления (С-реактивный белок) в первые сутки жизни. По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни делалось заключение о наличии или отсутствии у детей врожденной инфекции [2, 3]. Дифференциальный диагноз между врожденной пневмонией, сепсисом, РДС, транзиторным тахипноэ новорожденных (ТТН) проводили в соответствии с общепринятыми критериями [4, 5]. В зависимости от генеза дыхательных нарушений (ДН) дети, вошедшие в исследование, были разделены на две основные группы: в 1-ю группу вошли дети с неинфекционной природой ДН: (ТТН) или респираторным дистресс-синдромом (РДС) (n=161), во вторую – новорожденные с инфекционной природой ДН: врожденной пневмонией или ранним неонатальным сепсисом (РНС) (n=218). Дизайн исследования приведен на рис. 1.
Всем новорожденным с целью диагностики врожденной инфекции проводилось клинико-лабораторное обследование, включавшее в себя рентгенографию органов грудной полости, анализ гемокультуры, клинический анализ крови с подсчетом абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса, контроль уровня белков острой фазы воспаления (С-реактивный белок) в первые сутки жизни. По результатам проведенного клинико-лабораторного и инструментального обследования в возрасте 72 ч жизни делалось заключение о наличии или отсутствии у детей врожденной инфекции [2, 3]. Дифференциальный диагноз между врожденной пневмонией, сепсисом, РДС, транзиторным тахипноэ новорожденных (ТТН) проводили в соответствии с общепринятыми критериями [4, 5]. В зависимости от генеза дыхательных нарушений (ДН) дети, вошедшие в исследование, были разделены на две основные группы: в 1-ю группу вошли дети с неинфекционной природой ДН: (ТТН) или респираторным дистресс-синдромом (РДС) (n=161), во вторую – новорожденные с инфекционной природой ДН: врожденной пневмонией или ранним неонатальным сепсисом (РНС) (n=218). Дизайн исследования приведен на рис. 1.
Антропометрические данные недоношенных новорожденных оценивались с помощью центильных таблиц Fenton, доношенных – с помощью центильных таблиц Всемирной организации здравоохранения (ВОЗ).
Принимая во внимание результаты ранее проведенных нами исследований, выявивших особенности цитокинового статуса и экспрессии мРНК у новорожденных на разных сроках гестации [6–8], в данном исследовании дети основных групп были разделены на 4 подгруппы (24–28 недель, 29–32 недели, 33–36 недель, 37 и более недель) (рис. 1).
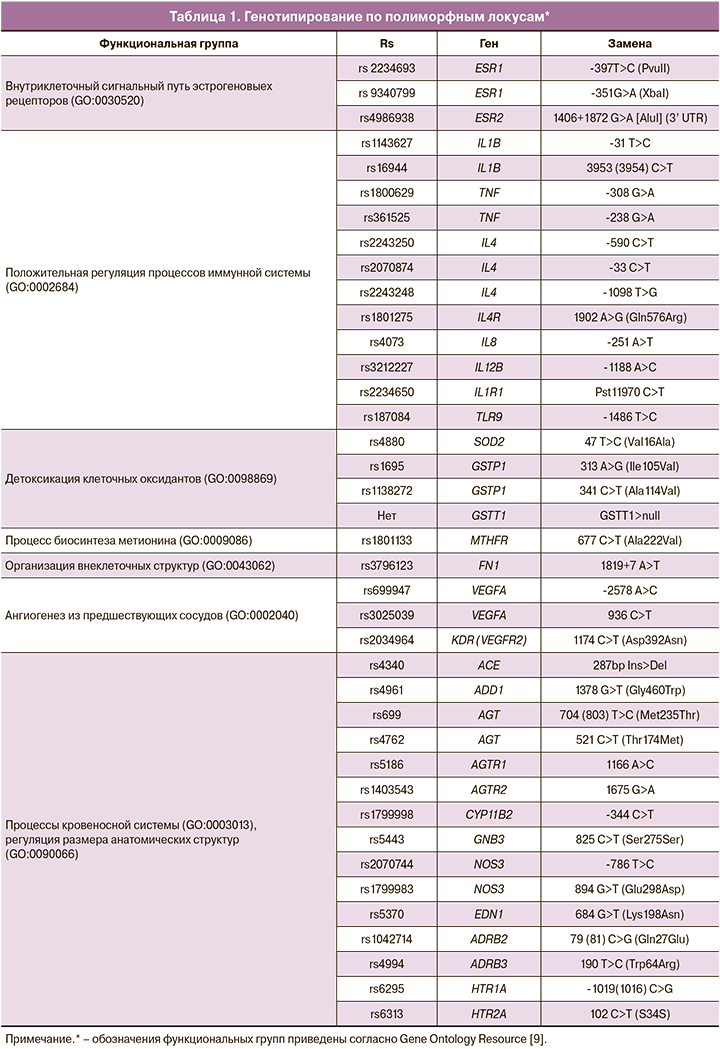
У всех новорожденных детей, включенных в исследование, взятие крови осуществлялось в пробирки с консервантом ЭДТА в первые сутки жизни одновременно с проведением обязательного клинико-лабораторного обследования при поступлении новорожденных в ОРИТН до начала специфической терапии. Генотипирование проводили по полиморфным локусам (обозначения функциональных групп приведены согласно Gene Ontology Resource [9]), приведенным в табл. 1.
Генотипирование выполняли методом ПЦР с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью диагностических тест-систем производства ООО «НПО ДНК-Технология», Россия.
ДНК для генотипирования выделяли из лимфоцитов периферической крови, взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Метод о...












