Урология №5 / 2018
Гистопатологическая оценка эволюции трансплантатов слизистой оболочки ротовой полости, используемых для аугментационной уретропластики
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России; Ростов-на-Дону, Россия; 2 ГБУ РО «Бюро судебно-медицинской экспертизы»; Ростов-на-Дону, Россия
Введение. Клиническая эффективность использования слизистой ротовой полости при аугментационных уретропластиках (АУ) убедительно доказана. Исследования, посвященные изучению морфологических изменений трансплантатов в процессе их приживления в уретре, практически отсутствуют.
Цель исследования: дать оценку гистопатологической эволюции трансплантатов слизистой ротовой полости, используемых для АУ.
Материалы и методы. В исследование включены 15 пациентов в возрасте 19–67 лет со стриктурами (3,5–11 см) пенильной и пенильно-бульбарной уретры, которым выполнена двухэтапная АУ по Asopa. В 9 случаях осуществлен анализ образцов тканей из ротовой полости после их забора (5 – щека и 4 – губа) и через 6 мес. после их приживления в уретре, полученных в ходе второго этапа операции. В 6 случаях изучены биоптаты трансплантатов при рецидивах стриктуры, возникших через 12–24 мес. после тубуляризации и потребовавших дополнительных вмешательств.
Результаты. Спустя 6 мес. общая структура трансплантатов сохранилась, наблюдались дистрофические изменения в эпителии, воспалительная инфильтрация и очаги фиброза в субэпителиальных отделах. Трансплантаты щеки отличались меньшей толщиной эпителия и наличием очагов ороговения. Через 12–24 мес. трансплантаты также сохранили свою структуру, отмечено снижение выраженности хронической воспалительной реакции и отсутствие ороговения плоского эпителия щеки. Стриктура в зоне анастомоза характеризовалась наличием склеротической и фиброзной соединительной ткани, покрытой уротелием.
Выводы. Трансплантаты слизистой ротовой полости полностью сохраняют свою гистологическую структуру в течение 1–2 лет и не являются структурной частью рецидивов стриктуры уретры, возникающих в зоне анастомоза трансплантата и собственной уретры.
Введение. Аугментационная уретропластика (АУ) – метод, широко используемый в лечении протяженных стриктур уретры (СУ) [1]. При этом в качестве пластического материала применяются кожа, влагалищная оболочка яичка, слизистая мочевого пузыря, подслизистая оболочка тонкой кишки [2–4]. Однако самая высокая результативность при АУ достигнута в последнее десятилетие при восстановлении уретры трансплантатами слизистой ротовой полости (губы, щеки, языка) [5, 6]. Несмотря на длительную историю метода (с начала 1990-х гг.), естественная морфологическая динамика трансплантируемых тканей после переноса их на материнское ложе остается не до конца изученной как в клинике [7, 8], так и в эксперименте [9–12]. Гистопатологическая эволюция трансплантатов слизистой губы, щеки после АУ и воздействия мочи, возможно, имея отличия от заместительной пластики уретры, нуждается в дополнительном изучении, что и определило цель настоящей работы.
Материалы и методы. С 2015 по 2017 г. проведено исследование, одобренное локальным этическим комитетом (№ 21/15 от 10.12.2015), в которое включены 15 больных в возрасте 19–67 лет с первичными (3,5–11 см) пенильными и пенильно-бульбарными СУ. Клинически диагноз СУ был установлен на основании данных ретроградной уретрографии и цистоуретрографии при микции, урофлоуметрии и в отдельных случаях – уретроцистоскопии.
Все пациенты перенесли двухэтапную уретропластику. На первом этапе выполняли вентральную и дорсальную уретротомии по Asopa с фиксацией трансплантата слизистой ротовой полости, марсупиализацию уретры с формированием двух неомеатусов. Через 6 мес. на втором этапе проводили тубуляризацию уретры. Во всех наблюдениях послеоперационный период протекал благоприятно на обоих этапах операции.
Осуществлен сравнительный анализ 5 образцов трансплантатов из щеки, 4 – из нижней губы после их забора из ротовой полости и через 6 мес. после их приживления в уретре, полученных в ходе операции второго этапа. В других 6 случаях имел место рецидив СУ после второго этапа операции и через 12–24 мес. после трансплантации больные были повторно оперированы с забором образцов тканей трансплантата на границе со стенозом собственной уретры пациента, а также зоны стеноза.
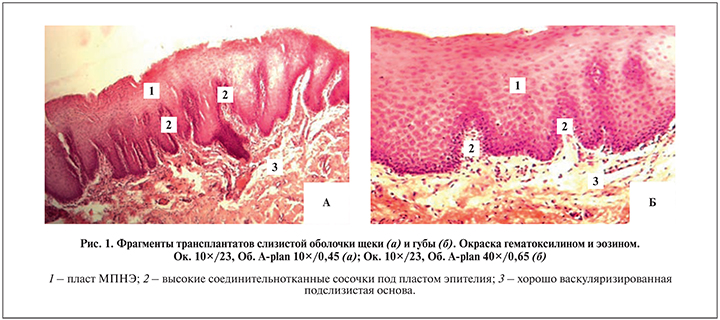
Все образцы ткани немедленно помещали в нейтральный забуференный 10%-ный формалин с последующей спиртовой проводкой в автоматизированном тканевом процессоре закрытого типа Sakura (Япония). Полученные срезы толщиной 5–6 мкм окрашивали гематоксилином и эозином и пикрофуксином по Ван–Г...












