Акушерство и Гинекология №12 / 2017
Гликом эндометрия в менструальном цикле и рецептивность эндометрия
1 ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова
Минздрава России, Москва;
2 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия;
3 ФГБОУ ВО Московский государственный университет им. М.В. Ломоносова, Россия;
4 Кафедра акушерства, гинекологии, перинатологии и репродукции ИПО ФГАОУ ВО
Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Цель исследования. Провести систематический анализ данных, имеющихся в современной литературе, о цикличности изменения гликома эндометрия, влиянии этих изменений на рецептивность и имплантацию.
Материал и методы. В обзор включены данные 46 зарубежных и отечественных статей, найденных в базе данных Pubmed по данной тематике, опубликованных за последние 22 года.
Результаты. Описаны изменения гликома эндометрия в зависимости от фазы менструального цикла. Показано, что максимальные изменения гликома отмечаются в окно имплантации. Продемонстрировано, что изменения экспрессии гликанов эндометриального эпителия как позитивно, так и негативно регулируют имплантацию.
Заключение. Установленные отличия гликома эндометрия в пролиферативную и секреторную фазы цикла свидетельствуют об участии гликанов в имплантации в качестве факторов, определяющих рецептивность. Представленные данные могут способствовать расширению знаний о патогенезе бесплодия и указывают на необходимость проведения дальнейших исследований, направленных на выявление гликанов как маркеров рецептивности эндометрия, с целью повышения эффективности программ вспомогательных репродуктивных технологий.
В настоящее время программы вспомогательных репродуктивных технологий (ВРТ) широко используются для лечения бесплодия – актуальной проблемы, с которой, по данным ВОЗ, сталкиваются 15–20% женщин репродуктивного возраста. Количество проводимых циклов ВРТ неуклонно растет, однако эффективность реализации программ не достигает желаемого успеха. По данным российской ассоциации репродукции человека (РАРЧ) частота наступления беременности после начатого цикла немногим превышает 30 и 27% в программах ЭКО и ИКСИ соответственно; родами заканчиваются около 20% начатых циклов [1].
Имплантация – процесс, в результате которого происходит прикрепление бластоцисты к эндометрию, внедрение клеток, формирующих в дальнейшем экстраэмбриональные структуры, в эпителий и сосуды матки, и последующее формирование плаценты [2]. Успех имплантации зависит от двух составляющих: качества эмбриона и состояния эндометрия [3]. Данный обзор сфокусирован на цикличности изменения гликома эндометрия, влиянии этих изменений на рецептивность, а также характеристике гликоконъюгатов как позитивных и негативных регуляторов имплантации.
Циклические изменения эндометрия: характеристика эндометриального паттерна и паттерна гликозилирования
В 1950 году Нойсом, Хертингом и Роком впервые были описаны морфологические, гистохимические и функциональные ежедневные изменения эндометрия на протяжении нормального 28-дневного цикла [4]. Также было показано, что циклическая трансформация эндометрия контролируется изменением активности гипоталамо-гипофизарной-яичниковой системы. В менструальном цикле женщины выделяется две фазы: пролиферативная – основным регулятором является эстроген, и следующая за овуляцией секреторная, детерминирующим регулятором которой служит прогестерон [4, 5]. Пролиферативная фаза включает раннюю, среднюю и позднюю стадии. В секреторной фазе выделяют стадии: ранняя постовуляторная фаза (ранняя стадия секреции) — (1–4 или 1–5 дней по данным разных авторов), характеризующаяся инициацией синтеза секреторных продуктов и наличием субнуклеарных вакуолей; средняя стадия секреции – период максимальной рецептивности эндометрия или окно имплантации (ОИ) (5–9-й или 6–10-й дни после овуляции), которую отличает псевдодециадуализация стромальных клеток и развитие эпителиальными клетками специализированных структур – пиноподий, экспрессия молекул клеточной адгезии; поздняя лютеиновая (секреторная) фаза – (10–14-й или 11–14-й дни) – диссоциация клеток эндометриальной стромы, активация апоптоза и отторжение слизистой оболочки матки (рис. 1) [6]. В случае наступления беременности строма эндометрия трансформируется в специализированную децидуальную ткань [7].
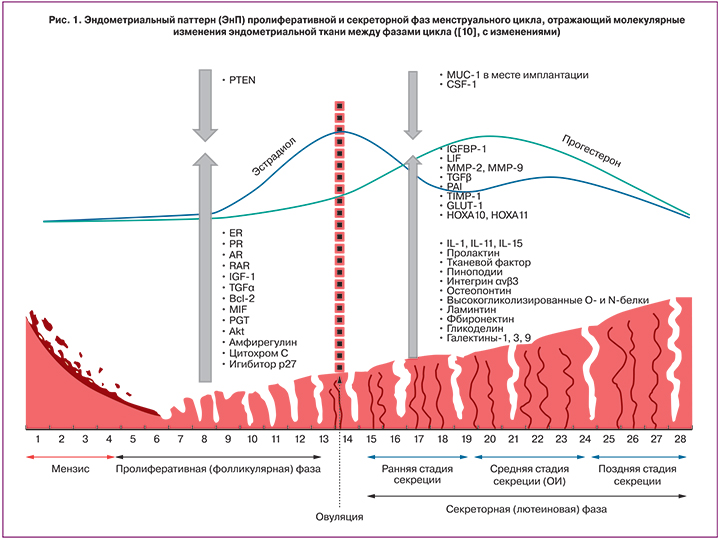
Для описания изменений функционального слоя эндометрия в нормальном цикле, а также при развитии нарушений в англоязычной литературе встречается термин «эндометриальный паттерн» (ЭнП, endometrial pattern), который отражает шаблон или образец визуализации эндометрия, соответствующий определенной фазе (стадии) менструального цикла, описанный с помощью ультразвукового исследования – единственного на сегодняшний день неинвазивного метода оценки эндометрия [8]. Термин «ЭнП», на наш взгляд, позволяет также описывать морфологические, гистохимические изменения эндометриальных клеток и изменения в экспрессии генов и молекулярных маркеров, что позволяет использовать его и в этом контексте. На рис. 1 представлены ЭнП, характеризующие пролиферативную и секреторную фазы менструального цикла и демонстрирующие участие гормональных, генетических и иммунологических факторов в дифференциации эндометрия [9, 10]. Рис. 1 также демонстрирует постовуляторные изменения гликозилирования эндометриальных и секреторных белков, которые мало изучены в репродуктивной медицине, но могут быть важной составляющей ЭнП, поскольку гликаны (углеводы) являются функциональной частью рецепторов, опосредующих межклеточные контакты, адгезию и процессы инвазии [11, 12].
Кроме ЭнП, в литературе используется также термин «паттерн гликозилирования», или гликом, характеризующий совокупность гликанов органа, клетки и растворимых белков биологических жидкостей организма [13, 14]. Особый интерес в настоящее время вызывают данные, основанные на изучении межвидового скрещивания, свидетельствующие, что клетки репродуктивных органов, гаметы и эмбрионы близкородственных видов млекопитающих имеют определенный паттерн (гликотип) гликозилирования [15]. Возможность контакта (оплодотворения, имплантации и плацентации) определяется комплементарностью гликозилированных поверхностей контактирующих клеток, что позволяет предположить наличие углеводного кода (гликокода) [16], значение которого может быть решающим для имплантации и развития беременности (рис. 2). Согласно теории гликокода, молекулярные основы имплантации основаны на углевод-белковом и углевод-углеводном взаимодействиях между клетками эндометрия и бластоцисты [11, 17].
Молекулярные основы углевод-опосредованных взаимодействий при имплантации
Установлено, что молекулярные ос...












