STROKE №4 (32) / 2013
Гранулоцитарный колониестимулирующий фактор у пациентов с острым ишемическим инсультом. Результаты испытания AX200 for Ischemic Stroke
Department of Neurology, University of Münster, Münster, Germany; Department of Neurology, University of Leuven, Leuven, Belgium; Vesalius Research Center, VIB, Leuven, Belgium; Department of Clinical Sciences, Section of Neurology, Lund University, Lund, Sweden; Department of Neurology, University of Barcelona, Barcelona, Spain; Department of Neurology, Nervenklinik Wagner-Jauregg, Linz, Austria; Department of Neurology, Kreiskrankenhaus Siegen, Siegen, Germany; Department of Neurology, University of California, Los Angeles; Clinical Research Department, SYGNIS Bioscience GmbH, Heidelberg, Germany; Center for Stroke Research, Charité, Berlin, Germany; Department of Neurology, Evangelisches Krankenhaus Bielefeld, Bielefeld, Germany; Department of Neurology, UMass Memorial Medical Center, Worcester, MA; Department of Neurology, Medical Faculty Hospital Nitra, Nitra, Slovakia; Department of Neurology, University Ostrava, Ostrava, Czech Republic; Department of Neurology, Allgemeines Krankenhaus Linz, Linz, Austria; Department of Neurology, Hospital Universitario Dr Josep Trueta de Girona, Girona, Spain; Department of Neurology, University of Heidelberg, Heidelberg, Germany; Department of Neurology, University of Erlangen, Erlangen, Germany; and Department of Neurologie, Klinikum Altenburger Land GmbH, Altenburg, Germany.
Предпосылки и цель исследования. Гранулоцитарный колониестимулирующий фактор (G-CSF; AX200; Filgrastim) является перспективным препаратом для лечения инсульта с отличными доклиническими доказательствами эффективности. Результаты предыдущего испытания IIa фазы с эскалацией дозы показали его потенциальную эффективность у людей. Настоящее крупное испытание IIb фазы обладало достаточной мощностью для обнаружения клинической эффективности у пациентов с острым ишемическим инсультом. Методы. В международном многоцентровом рандомизированном плацебо-контролируемом исследовании (NCT00927836; www.clinicaltrial.gov) изучали эффективность G-CSF (внутривенное введение 135 мкг/кг массы тела в течение более 72 часов) по сравнению с плацебо
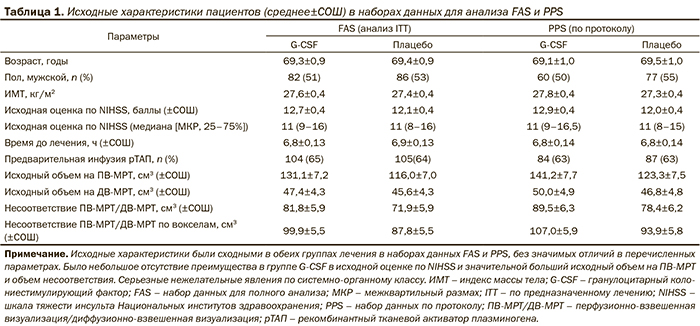
у 328 пациентов. Основными критериями включения были: ≤9 часов с момента появления симптомов инсульта, локализация инфаркта в бассейне средней мозговой артерии, исходная оценка по шкале тяжести инсульта Национальных институтов здравоохранения от 6 до 22 баллов и исходный объем поражения при проведении диффузно-взвешенной МРТ ≥15 мл. Первичной и вторичной конечными точками были оценка по модифицированной шкале Рэнкина и оценка по шкале тяжести инсульта Национальных институтов здравоохранения на 90-й день соответственно. Данные проанализировали с использованием заранее определенной модели, в которую вносили поправки на возраст, оценку по шкале тяжести инсульта Национальных институтов здравоохранения в начале исследования, и исходный объем очага ишемии (диффузно-взвешенная МРТ). Результаты. При лечении G-CSF не удалось достичь первичной и вторичной конечных точек испытания. По дополнительным конечным точкам, таким как летальность, индекс Бартел или размер очага инфаркта на 30-й день, также не удалось продемонстрировать эффективности G-CSF. Тем не менее обнаружили тенденцию к уменьшению объема очага ишемии в группе G-CSF. При лечении G-CSF показали ожидаемые периферические фармакокинетические и фармакодинамические профили со значительным увеличением содержания лейкоцитов и моноцитов. Параллельно с этим при изучении профиля цитокинов обнаружили значительное снижение содержания интерлейкина-1. Выводы. G-CSF, новый и перспективный препарат с обширными доклиническими и клиническими данными не обладает любыми значимыми преимуществами относительно клинического исхода или радиологических маркеров.
Гранулоцитарный колониестимулирующий фактор (G-CSF) является фактором роста, который используется в клинической практике для лечения нейтропении, ассоциированной с химиотерапией [1].
В течение последних 9 лет большое количество данных убедительно свидетельствовало о том, что G-CSF является мощным нейрональным фактором роста с мультимодальными антиапоптотическими, артериогенными и нейрогенными свойствами [2–4]. Многочисленные данные исследований на животных из разных лабораторий и их мета-анализ показали, что G-CSF является одним из наиболее перспективных кандидатов для лечения инсульта [5–7]. В частности, было продемонстрировано, что лечение G-CSF приводило к улучшению функционального восстановления после инсульта в отдаленном периоде, даже если лечение было отложено на несколько дней [8]. В клиническом испытании IIa фазы у 43 пациентов с острым ишемическим инсультом продемонстрировали возможность и без-опасность внутривенного введения G-CSF при остром инсульте [9]. В этом испытании удалось определить, что оптимальный режим дозирования препарата составляет 135 мкг/кг массы тела в течение 72 часов. Цель испытания AX200 for Ischemic Stroke 2 (AXIS 2)заключалась в демонстрации клинической эффективности этой дозы при лечении острого ишемического инсульта.
МАТЕРИАЛЫ И МЕТОДЫ
Тип исследования и рандомизация
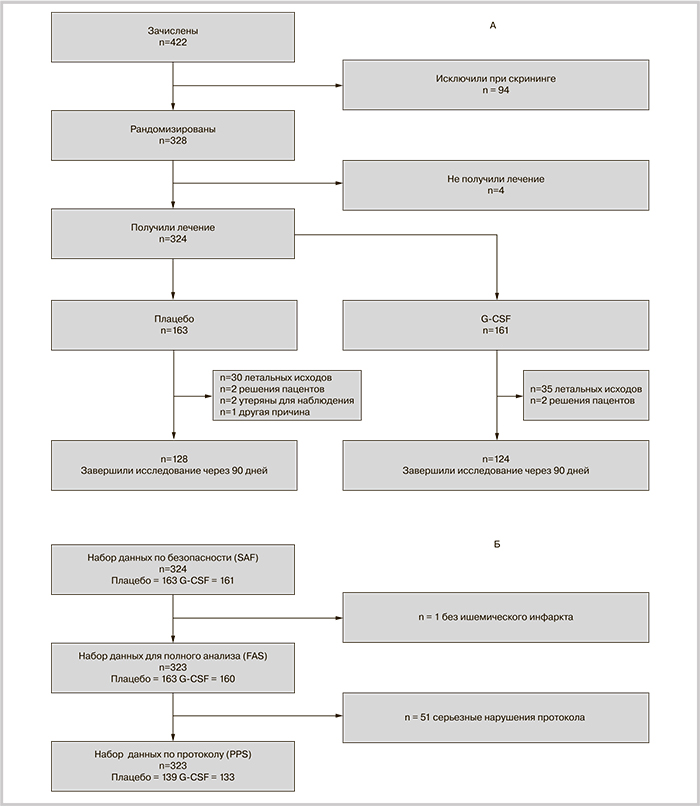
AXIS 2 — европейское многоцентровое плацебо-контролируемое рандомизированное двойное слепое испытание. Исследование было проведено в соответствии с International Conference of Harmonization Good Clinical Practice и одобрено соответствующими регулирующими органами: первое одобрение получили от ведущего комитета по этике в Линце, Австрия, 16 марта 2009 г.; первое официальное одобрение на проведение испытания по всей стране (Австрия) получили 31 марта 2009 г. локальными этическими комитетами всех центров исследования. Для включения пациентов в испытание было необходимо получение информированного согласия. Дизайн и содержание формы согласия соответствовали правилам страны и были утверждены ведущим и локальными комитетами по этике. Пациентов с острым ишемическим инсультом рандомизировали в группы плацебо или препарата с помощью интерактивной системы посредством сети Интернет.
Дозирование и способ применения препаратов
Эффективность рекомбинантного человеческого G-CSF (Filgrastim; AX200; SYGNIS, Германия) при внутривенном введении в суммарной дозе 135 мкг/кг массы тела в течение 72 часов сравнивали с идентичным по внешнему виду плацебо (физиологический раствор). Треть общей суммарной дозы вводили в виде внутривенного болюса (30-минутная инфузия), в то время как остальную часть дозы вводили путем непрерывной внутривенной инфузии с постоянной скоростью в течение 72 часов. Для инфузии исследуемый препарат разводили в 5% растворе декстрозы.
Дизайн исследования: критерии включения и исключения
Основными критериями включения были: исходная оценка по шкале тяжести инсульта Национальных институтов здравоохранения (NIHSS) от 6 до 22 баллов, возраст от 18 до 85 лет, временнóе окно ≤9 часов после появления симптомов инсульта и локализация очага инфаркта в бассейне средней мозговой артерии. Мы выбрали временнóе окно в 9 часов на основе консенсуса между членами Руководящего совета, с учетом предполагаемого механизма действия G-CSF (нейропротекторные и нейрорегенеративные свойства). Для выявления возможной зависимости эффекта G-CSF от временнóго окна, заранее определили подгруппы пациентов в соответствии со временем включения и провели регрессионный анализ с фактором времени включения. Для включения в исследование были необходимы результаты МРТ. Выбрали минимальный размер очага поражения по данным диффузно-взвешенной МРТ (ДВ-МРТ) в 15 мл, и подсчет вели по следующим правилам: на срезе с наибольшей площадью очага ишемии наибольший диаметр поражения должен быть ≥3 см и должен быть виден на ≥3 последовательных срезах (при толщине среза 5 мм). При неприменимости этого правила (например, при неправильной форме или частично разделенных областях ишемии на срезах) пациента можно было включить в клиническое исследование при письменном обосновании исследователя о соответствии указанного пациента критериям включения. Лечение с использованием рекомбинантного тканевого активатора плазминогена (рТАП) разрешали при соответствии пациентов всем критериям включения. Основными критериями исключения были: признаки очень тяжелого инсульта, по данным МРТ (окклюзия сонной артерии, поражение более двух третей бассейна СМА, признаки дислокации мозга), наличие геморрагического или лакунарного инсульта.
Первоначальный протокол изменили для улучшения отбора участников после того, как 21 пациент уже был отобран. В соответствии с поправкой, исходная оценка по NIHSS для включения в исследование была снижена с 8 до 6 баллов, допускали участие пациентов с ранее проведенным системным тромболизисом, но соответствующих всем...












