Терапевтический справочник. Путеводитель врачебных назначений №2 (5) / 2017
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ
ФГБОУ «ВО МГМСУ им. А.И. Евдокимова Минздрава России»
В настоящее время хроническая обструктивная болезнь легких является глобальной проблемой: в разных странах мира ее встречаемость варьирует от 6 до 20%. Грамотные диагностические и терапевтические подходы позволяют предотвратить и эффективно лечить это заболевание.
Хроническая обструктивная болезнь легких (ХОБЛ) – хроническое гетерогенное заболевание с персистирующими респираторными симптомами и ограничением воздушного потока, связанными с развитием аномалий структуры дыхательных путей и/или альвеол, которые возникают из-за значительного воздействия токсических частиц или газов. Такое хроническое воспаление может вызывать деструкцию паренхимы (ведущую к развитию эмфиземы) и нарушать нормальные восстановительные и защитные механизмы, препятствующие фиброзу мелких бронхов.
Коды ХОБЛ по МКБ 10: J44.0 – J44.1, J44.8 – J44.9 – раздел «другая хроническая обструктивная легочная болезнь».
ЭПИДЕМИОЛОГИЯ
По данным глобального исследования BOLD, распространенность ХОБЛ среди лиц старше 40 лет находится в пределах 10,1 ± 4,8%: 11,8 ± 7,9% у мужчин 8,5 ± 5,8% у женщин. В свою очередь, согласно результатам поперечного популяционного эпидемиологического исследования в 12 регионах России (GARD) с участием 7164 человек (средний возраст 43,4 года), частота заболевания в нашей стране среди лиц с респираторными симптомами составила 21,8%, а в общей популяции – 15,3%.
В Европе смертность от ХОБЛ значительно варьирует: от 0,20 на 100 000 населения в Греции, Швеции, Исландии и Норвегии до 80 на 100 000 в Румынии. Основной причиной смерти больных ХОБЛ становится прогрессирование основного заболевания: от 50 до 80% пациентов ХОБЛ умирают вследствие острой дыхательной недостаточности (во время обострений болезни), опухолей легких (от 8,5 до 27%), либо других респираторных проблем.
ЭТИОЛОГИЯ
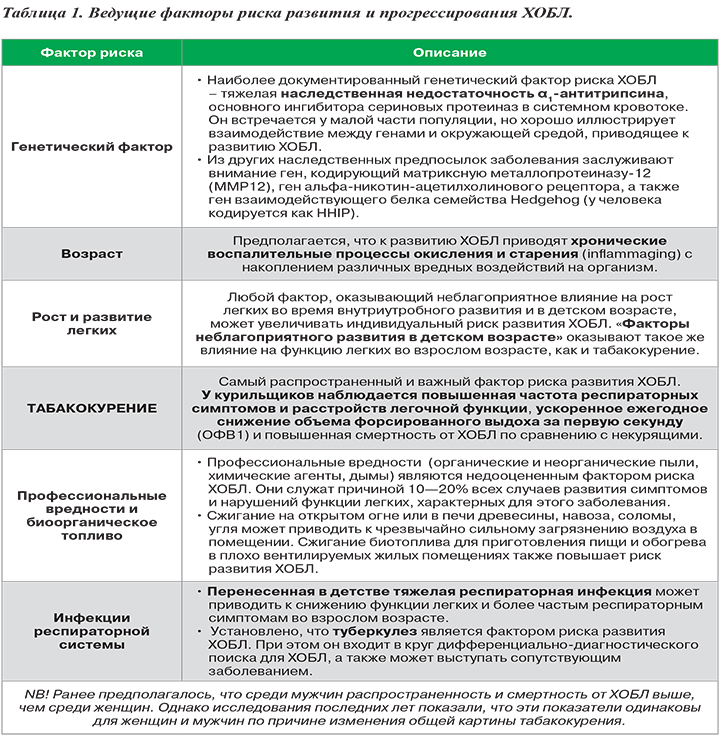
К основным факторам риска ХОБЛ относятся неблагоприятная генетика, возраст, рост и развитие легких, курение, профессиональные вредности, респираторные инфекции. Их влияние на развитие и прогрессирование этого заболевания отражены в таблице 1.
Патогенез ХОБЛ
Воспаление в дыхательных путях пациентов с ХОБЛ выглядит как усиленный нейтрофильный воспалительный ответ дыхательных путей на длительно воздействующие раздражающие факторы (например, сигаретный дым). Механизмы такого усиления не вполне понятны, но могут быть генетически обусловлены. В ряде случаев ХОБЛ может развиться у некурящих лиц. В последние годы находит подтверждение концепция ускоренного окисления и старения (inflammaging) или «преждевременного старения легкого».
Окислительный стресс при ХОБЛ может играть роль важного амплификатора (механизма активации онкогенов). У пациентов с ХОБЛ обнаруживают повышение маркеров окислительного стресса (перекиси водорода, 8-изопростана) в конденсате выдыхаемого воздуха, мокроте и системном кровотоке. Это приводит к активации клеток воспаления, в частности макрофагов и нейтрофилов.
Предполагается, что у пациентов ХОБЛ нарушен баланс между протеиназами, расщепляющими компоненты соединительной ткани, и антипротеиназами, защищающими от действия протеиназ. Разрушение протеиназами эластина, главного соединительнотканного компонента паренхимы легких, служит важной характерной особенностью эмфиземы и является необратимым.
При ХОБЛ отмечается специфическая для курящих людей картина воспаления с повышением числа CD8+ (цитотоксических) Tc1-лимфоцитов. Эти клетки, а также нейтрофилы и макрофаги, выделяют медиаторы воспаления и взаимодействуют со структурными клетками дыхательных путей, паренхимы и сосудов легких.
Также установлено, что у пациентов ХОБЛ повышаются концентрации воспалительных медиаторов, которые привлекают воспалительные клетки из кровотока (факторы хемотаксиса), усиливают воспалительный процесс (провоспалительные цитокины) и вызывают структурные изменения (факторы роста).
Патофизиология ХОБЛ
Признается, что лежащие в основе ХОБЛ воспалительные процессы приводят к формированию характерных структурных и физиологических нарушений. Например, изменение соотношения ОФВ1/ФЖЕЛ <0,70 («воздушная ловушка») обусловлено коллапсом мелких дыхательных путей на выдохе, а величина изменений диффузионной способности легких (DLCO) отражает степень разрушения паренхимы при эмфиземе.
Феномен «воздушной ловушки», который обнаруживают у больных с ХОБЛ при выполнении функционального легочного теста (спирометрии), представляет собой утрату способности дыхательных путей сохранять просвет открытым во время выдоха, особенно при выполнении физической нагрузки. Утрата «легочного каркаса» при эмфиземе, потеря структурных связей между альвеолами и мелкими бронхами существенно изменяют эластические свойства легких. Это нарушает баланс механических сил, способствующих растяжению и сжатию легких, и приводит к повышению объема легких в конце спокойного выдоха (функциональной остаточной емкости). Описанное явление носит название «статической гиперинфляции» легких, или гипервоздушность покоя. В свою очередь увеличение функциональной остаточной емкости (ФОЕ) при присоединении динамического компонента обозначается термином «динамическая гиперинфляция» легких, или гипервоздушность нагрузки (рис. 1).












