Фарматека №17 (270) / 2013
Имплантируемые морфиновые помпы в терапии хронического болевого синдрома у онкологических больных. Первый клинический опыт
1 Отделение нейрохирургии МНИОИ им. П.А. Герцена, Москва 2 Центр паллиативной помощи онкологическим больным МНИОИ им. П.А. Герцена, Москва
Описан первый в России опыт апробирования методики хронической интратекальной терапии с помощью имплантируемых программируемых помп. Целью исследования стала разработка метода терапии тяжелых хронических болевых синдромов (ХБС) для улучшения качества жизни больных, получающих высокие дозы опиоидных анальгетиков, путем длительного интратекального введения микродоз морфина, вводимого имплантируемой программируемой помпой. В исследование были включены 10 больных, из них 9 – с ХБС онкологического генеза и 1 больной – с неопухолевой патологией. На первом этапе проведен морфиновый тест, в случае положительного теста осуществлена имплантация помпы. Интенсивность боли оценивали по общепринятым шкалам оценки. Все пациенты отметили более эффективное обезболивание, отсутствие системных опиоидзависимых побочных эффектов и повышение качества жизни после подбора программы индивидуального режима введения морфина помпой.
Актуальность проблемы
В России нет единой статистики распространенности хронического болевого синдрома (ХБС). В мире ХБС в настоящий момент рассматривается как самостоятельная болезнь, требующая этиопатогенетического лечения. Распространенность ХБС в популяции оценивается от 2 до 40–49 %. Особое значение ХБС имеет в онкологической практике, где на начальном этапе опухолевого процесса боль беспокоит около 50 % больных, при прогрессировании – 75 %, а в терминальной стадии до 90 % онкологических пациентов считают боль основным симптомом опухоли [1, 2]. Лечение хронической боли как онкологического, так и неонкологического генеза является до конца не решенной задачей. Всемирная организация здравоохранения приводит универсальный алгоритм терапии боли в онкологии – «обезболивающая лестница ВОЗ», который предписывает ступенчатое назначение анальгетиков – от неопиоидных к слабым опиоидам, а затем применяются при их неэффективности сильнодействующие опиоидные средства – морфин и синтетические опиоиды [World Health Organization, 1986; Vancouver Hospice Program, 1989] [3]. Этот фундаментальный алгоритм, составленный более 20 лет назад, останавливается на методике лечения сильной боли сильным опиоидом в сочетании с нестероидным противовоспалительным средством и адъювантным препаратом. При этом вопрос о терапии при прогрессировании боли выше 3-й ступени при неэффективности предложенного лечения остается без ответа. Следующим этапом при неэффективности консервативной терапии боли предложены инвазивные методики. Интервенционные методики лечения ХБС подразделяются на минимально инвазивные – такие, как нейромодуляция и нейростимуляция, и деструктивные операции, к которым относятся симпатэктомия, деструкция входной зоны задних корешков (DREZ), хордо- и цингулотомия. Особый интерес для функционально сохранных больных представляют минимально инвазивные методики. Под нейромодуляцией подразумевают метод терапевтического воздействия на функции нервной системы с помощью недеструктивных электрических и медиаторных средств. При выраженной спастичности и преимущественно невропатическом характере болей с успехом применяется хроническая электростимуляция. В онкологической практике, где боль чаще носит ноцицептивный характер, актуальным становится интратекальное введение лекарственных препаратов.
Этиологическим фактором 10 % хронических болевых синдромов остается онкологический процесс [3]. Группа больных с ХБС онкологического генеза чрезвычайно сложна. Если пациента с неонкологической болью присуща некая стабильная интенсивность боли, которая остается неизменной порой многие годы, то при лечении онкологической боли уже на ранних этапах лечения можно прогнозировать постепенный рост интенсивности боли как следствие расширения поверхности ноцицепции. Лечение хронической боли в такой ситуации всегда должно иметь резервы для расширения фармакологической поддержки. У онкологической боли в отличие от любой другой есть и патогенетические отличия. Возникновение и поддержание онкологической боли обусловлены активацией ноцицептров такими медиаторами, как простагландины, внеклеточные ионы водорода Н+, эндотелин-1, субстанция Р, интерлейкины и фактор некроза опухоли. Особенностью формирования онкологической боли служит способность болевых рецепторов возбуждаться не только в ответ на взаимодействие с воспалительными альгогенами, но и при специфическом воздействии опухолевых факторов, что способствует усилению восприятия и проведения болевых импульсов [4]. Восприятие болевых стимулов происходит на всех уровнях нейрооси – от периферии до коры головного мозга. На каждом из этих уровней действуют различные нейромодуляторные и нейроэндокринные механизмы. В настоящее время ни одну нейромодуляторную систему или отдельно взятый нейротрансмиттер нельзя расценивать как исключительный в рецепции или модуляции боли.
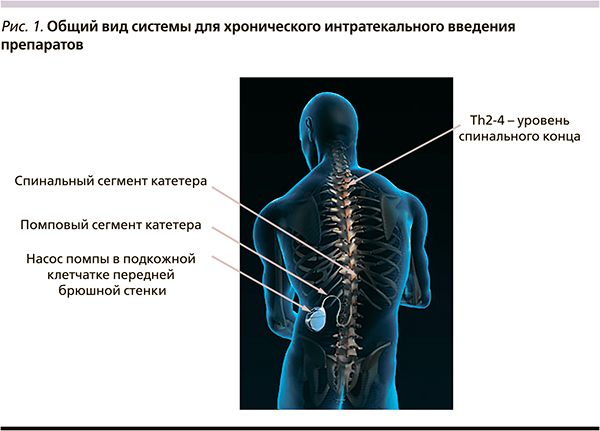
Эффекты введения морфина в спинномозговую жидкость изучаются с 1970-х гг., когда были открыты опиатные рецепторы и эндогенные опиаты. В 1979 г. французские исследователи во главе с Le Motte обнаружили опиоидные рецепторы в спинном мозге приматов [5]. С того времени опиоиды стали применяться с целью купирования острой и хронической боли. Морфин и другие опиоиды успешно применяются для купирования болевого синдрома при инфаркте миокарда, почечной колике, для обезболивания родов, а также для пролонгированного послеоперационного обезболивания у кардиохирургических, ортопедических и спинальн...












