Урология №4 / 2018
Интраоперационные осложнения радикальной цистэктомии с различными вариантами деривации мочи
Национальный центр онкологии; Азербайджан, Баку
Цель работы. Изучить частоту, характер и факторы риска развития интраоперационных осложнений у больных раком мочевого пузыря, перенесших радикальную цистэктомию с различными вариантами отведения мочи.
Материалы и методы. В исследование включены 257 пациентов, перенесших радикальную цистэктомию. Из них мужчин – 241 (93,8%), женщин – 16 (6,2%). Средний возраст пациентов составил 58,5 (37–81) лет. Проведена оценка объема интраоперационной кровопотери, частоты ранений кровеносных сосудов, прямой кишки и запирательного нерва, длительности оперативного вмешательства, среднего объема кровопотери и гемотрансфузии в зависимости от метода отведения мочи и удаления мочевого пузыря, характера операций, стадии опухолевого процесса – рТ и рN, индекса массы тела, а также общего количества радикальных цистэктомий, выполненных хирургической бригадой.
Результаты. Интраоперационная летальность составила 0,4%. Интраоперационные осложнения зарегистрированы у 34 (13,2%) пациентов. Средний объем кровопотери составил 597 (100–2500) мл,
средний объем интра- и периоперационной гемотрансфузии – 950 и 310 мл соответственно. Статистически значимыми предикторами интраоперационной кровопотери стали индекс массы тела (р=0,001), опыт хирурга (р=0,004) и наличие метастатических лимфоузлов – N+ (р=0,033). Достоверным фактором, влияющим на частоту повреждений прямой кишки, является стадия болезни рТ4 (р=0,028). Анализ частоты повреждений запирательного нерва от вышеуказанных факторов не показал статистически значимой разницы (р>0,05).
Заключение. Пациенты с местнораспространенным РМП и высоким показателем индекса массы тела должны быть оперированы высококвалифицированными хирургами с опытом выполнения не менее
50 радикальных цистэктомий в год.
Введение. Современные принципы лечения пациентов с агрессивными формами рака мочевого пузыря (РМП) характеризуются стремлением к радикальному удалению пораженного опухолью мочевого пузыря с последующим формированием резервуаров из различных отделов кишечника [1]. До недавнего времени радикальная цистэктомия (РЦЭ) рассматривалась как инвалидизирующая операция, сопряженная с высокой летальностью и риском развития тяжелых послеоперационных осложнений.
Сегодня цистэктомия в радикальном объеме включает удаление единым блоком вместе с мочевым пузырем прилежащей брюшины и паравезикальной клетчатки. У мужчин удалению вместе с мочевым пузырем подлежат предстательная железа и семенные пузырьки с прилегающей жировой клетчаткой, проксимальные части семявыносящих протоков и 1–2 см проксимальной уретры; у женщин – матка с придатками и уретра с передней стенкой влагалища. Операция сочетается с тазовой лимфаденэктомией (ЛАЭ) [1–3]. К основным вариантам отведения мочи на сегодняшний день относятся методики орто- и гетеротопической деривации мочи в изолированные сегменты тонкой кишки [4–6]. Естественно, что такой объем оперативного вмешательства чреват различными интра- и послеоперационными осложнениями.
Наиболее частыми интраоперационными осложнениями РЦЭ служат кровотечения, травмы прямой кишки и запирательного нерва. С развитием знаний по анатомии малого таза и усовершенствованием хирургической техники выполнения РЦЭ частота вышеуказанных осложнений сведена к минимуму. Однако даже в клиниках с опытом выполнения более 100 РЦЭ в год осложнения в ходе этих операций по-прежнему встречаются и считаются одной из актуальных проблем онкоурологии [6–8].
Цель работы: изучить частоту, характер и факторы риска развития интраоперационных осложнений у больных РМП, перенесших РЦЭ.
Материалы и методы. С августа 2008 по декабрь 2017 г. в отделении онкоурологии Национального центра онкологии Минздрава Азербайджанской Республики выполнено 257 цистэктомий с различными вариантами отведения мочи. Среди прооперированных мужчин было 241 (93,8%), женщин – 16 (6,2%). Средний возраст пациентов составил 58,5 (37–81) лет. Объем оперативного вмешательства в 246 (95,7%) случаях соответствовал всем принципам радикализма. В остальных 11 (4,3%) операции по определенным причинам были выполнены без тазовой ЛАЭ. Все операции проведены тремя хирургами, работавшими в одной бригаде, с одинаковым опытом выполнения РЦЭ.
Для оценки частоты, характера и факторов риска интраоперационных осложнений был проведен анализ с использованием блока статистических программ SPSS 18.0 for Windows. Сравнительный анализ результатов и статистически значимую взаимосвязь оценивали по критериям Пирсона. Были проанализированы следующие переменные: метод отведения мочи и удаления мочевого пузыря, характер операций, стадия опухолевого процесса – рТ и рN, индекс массы тела (ИМТ) и число РЦЭ, выполненных хирургической бригадой (см. таблицу).
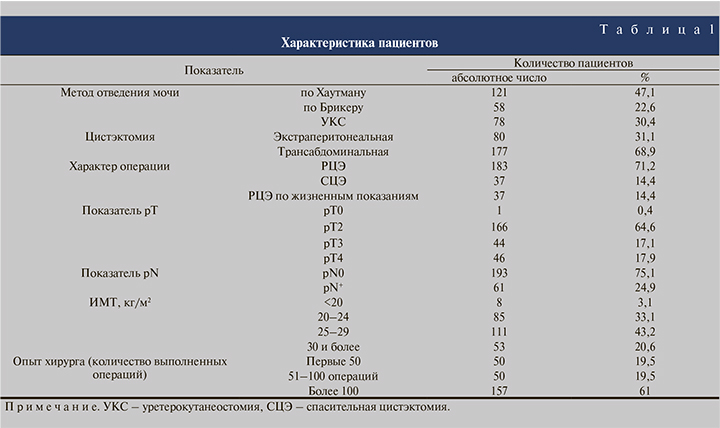
Среди интраоперационных осложнений оценивали объем интраоперационной кровопотери, частоту ранений кровеносных сосудов, прямой кишки и запирательного нерва. Также изучены длительность оперативного вмешательства, средний объем кровопотери и гемотрансфузий.
Результаты. Под интраоперационными понимали осложнения, которые наблюдались на операционном столе ...












