Кардиология №2 / 2016
Исследование ассоциаций полиморфизмов генов-кандидатов сердечно-сосудистых заболеваний со снижением скорости клубочковой фильтрации у больных инфарктом миокарда с подъемом сегмента ST
1ФГБНУ НИИ комплексных проблем сердечно-сосудистых заболеваний, Кемерово; 2ФГБНУ НИИ медицинской генетики, Томск; 3ГБОУ ВПО Кемеровская государственная медицинская академия Минздрава РФ, Кемерово
Целью исследования явилось изучение ассоциации полиморфных вариантов генов воспалительного ответа, функции эндотелия, липидного обмена и коагуляции крови с нарушением функции почек у больных инфарктом миокарда с подъемом сегмента ST (ИМпST). Материал и методы: в исследование включен 171 пациент, госпитализированный по поводу ИМпST давностью менее 24 ч. У всех определены генотипы по 25 полиморфным вариантам 18 важнейших генов-кандидатов сердечно-сосудистых заболеваний. Генотипирование проводили с помощью ДНК-чипа СИНКАР-1 (разработчики НИИ медицинской генетики СО РАМН и ООО «Геномная диагностика»). Результаты: сравнение частот аллелей и генотипов по изучаемым полиморфизмам показало, что rs4291 гена ангиотензинпревращающего фермента (ACE) имел ассоциацию со снижением скорости клубочковой фильтрации (СКФ): отношение шансов (OШ) для носителей более редкого генотипа ТТ составило 2,31 при 95% доверительном интервале (ДИ) от 1,01 до 5,25; р=0,043. Анализ сочетаний генотипов полиморфизмов rs4343 гена ACE и rs1800588 гена печеночной липазы (LIPC) выявил, что генотип АА полиморфизма rs4343 в сочетании с генотипом СС полиморфизма rs1800588 ассоциирован с наименьшим риском дисфункции почек, тогда как генотипы GG и AG полиморфизма rs4343 гена ACE в сочетании с генотипами TT и CT полиморфизма rs1800588 гена LIPC — с наибольшим риском. При анализе сочетаний генотипов по трем локусам: rs4291 и rs4343 гена ACE и rs1800588 гена LIPC выявлено, что сочетание генотипов по трем генетическим вариантам приводит к значительному увеличению риска (ОШ 4,42 при 95% ДИ от 1,37 до 14,26; р=0,012). Заключение: у больных ИМпST имеется ассоциация между сниженной СКФ, оцененной по уровню креатинина в сыворотке крови при поступлении в клинику, и генотипом TT rs4291 гена АСЕ, а также с сочетаниями генотипов rs4291, rs4343 гена ACE и rs1800588 гена LIPC. Более высокие значения ОШ, полученные для сочетаний данных генотипов по трем полиморфизмам, свидетельствуют о суммировании эффектов влияния генетических локусов на изучаемый признак.
Хроническая болезнь почек (ХБП) широко распространена во всем мире и ассоциируется с повышенным риском смерти у пациентов с острым коронарным синдромом (ОКС) [1, 2]. Это обусловливает актуальность ранней диагностики и профилактики ХБП.
Данные об ассоциациях генетических полиморфизмов с нарушением функции почек у пациентов с сердечно-сосудистыми заболеваниями (ССЗ) ограничены. Вместе с тем известны генетические маркеры диабетической нефропатии (ДН) [3], различных наследственных заболеваний почек [4], терминальной стадии почечной недостаточности (ПН) [5]. A. Köttgen и соавт. в 2010 г. опубликовали результаты исследования с участием более 40 тыс. пациентов, выявившего ассоциацию некоторых однонуклеотидных полиморфизмов (SNP) генов UMOD, SHROOM3 и GATM-SPATA5L1 со снижением скорости клубочковой фильтрации (СКФ) [6, 7]. В работе Y.C. Campbell и соавт. (2010) показана ассоциация полиморфных вариантов (M235T и rs2148582 гена AGT и rs2131127 гена AGTR1) с уровнем СКФ менее 60 мл/мин/1,73 м2 [8].
При этом исследования, посвященные анализу ассоциации структурных полиморфизмов генов с нарушением функции почек у больных инфарктом миокарда (ИМ), практически отсутствуют.
Цель исследования: изучить ассоциации полиморфных вариантов генов воспалительного ответа, функции эндотелия, липидного обмена и коагуляции крови с нарушением функции почек у больных ИМ с подъемом сегмента ST (ИМпST).
Материал и методы
В исследование включен 171 пациент, госпитализированный в Кемеровский кардиологический диспансер по поводу ИМпST давностью менее 24 ч. Средний возраст больных составил 58,7 (57,4—60,0) года.
Алгоритм обследования включал сбор жалоб, данных анамнеза, клинический осмотр кардиологом, запись электрокардиограммы, оценку уровня кардиоспецифических ферментов, контроль показателей системной гемодинамики, проведение эхокардиографии в 1-е сутки заболевания.
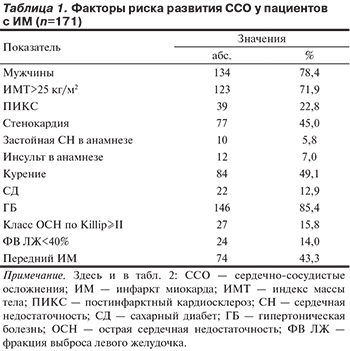 Средняя оценка риска по шкале GRACE составила 136,3 (132,5—140,1) балла, по шкале TIMI — 2,9 (2,6—3,2)балла. В табл. 1 приведены данные о частоте выявления традиционных факторов риска развития сердечно-сосудистых осложнений (ССО) в исследованной группе больных.
Средняя оценка риска по шкале GRACE составила 136,3 (132,5—140,1) балла, по шкале TIMI — 2,9 (2,6—3,2)балла. В табл. 1 приведены данные о частоте выявления традиционных факторов риска развития сердечно-сосудистых осложнений (ССО) в исследованной группе больных.
Всем пациентам в кратчайшие сроки определяли предпочтительный метод реперфузии миокарда — чрескожное коронарное вмешательство (ЧКВ) или системная тромболитическая терапия (ТЛТ). Реваскуляризацию миокарда не проводили при наличии технических ограничений вследствие особенностей анатомии коронарных сосудов, противопоказаний к ТЛТ или ЧКВ. Процедуре стентирования коронарных артерий подверглись 128 (74,8%) пациентов, ТЛТ — 11 (6,4%).
На 10—14-е сутки выполняли цветовое дуплексное сканирование экстракраниальных артерий и артерий нижних конечностей.
Расчет СКФ на момент поступления и выписки (16—20-е сутки от начала госпитализации) проводили по формуле MDRD (Modification of Diet in Renal Disease) [9]. Средние значения данного показателя в 1-е и на 16—20-е сутки у 171 пациента значимо не различались и составили 71,2 (68,2—74,2) и 71,3 (68,9—73,6) мл/мин/1,73 м2 соответственно (р=0,9). Таким образом, последующие расчеты данных проводили исходя из СКФ, оцененной при поступлении. Среди обследованных больных 90 (52,6%) имели указания на наличие в анамнезе патологии почек: мочекаменная болезнь у 3 (3,3%), хронический пиелонефрит у 85 (94,4%), ДН у 2 (2,3%) больных. При этом достоверных различий по СКФ у пациентов с и без заболеваний почек нами выявлено не было: 68,4 (64,3—72,5) и 74,3 (70,1—78,6) мл/мин/1,73 м2 соответственно; р=0,09.
У всех пациентов определены генотипы по 25 полиморфным вариантам 18 важнейших генов-кандидатов ССЗ [10].
Генотипирование проводили с помощью ДНК-чипа СИНКАР-1 (разработчики НИИ медицинской генетики СО РАМН и ООО «Геномная диагностика»). Использованный метод описан нами ранее [10].
Статистическую обработку данных осуществляли с помощью программ Statistica версии 10.0 и JMP версии 8.
Для анализа различий частот генотипов и аллелей использовали χ2-критерий Пирсона или точный тест Фишера при малом количестве наблюдений в какой-либо из подгрупп. Для оценки риска снижения СКФ в зависимости от генотипа рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ). Для выявления прогностической значимости генетических полиморфизмов в отношении дисфункции почек (ДП) проводили регрессионный анализ с пошаговым алгоритмом отбора. Различия считали статистически значимыми при р<0,05.
Результаты
По результатам анализа показателей СКФ, оцененных в 1-е сутки, пациенты были разделены на 2 группы. В 1-ю вошел 121 пациент с нормальной СКФ (>90 мл/...












