Фарматека №6 (359) / 2018
История, эпидемиология и клинические характеристики нежелательных явлений: обзор данных
Институт междисциплинарной медицины, Москва, Россия
Несмотря на то что современные лекарственные средства производят согласно современным требованиям, проблема развития нежелательных реакций по-прежнему остается весьма актуальной. Чаще всего реакции наблюдаются со стороны желудочно-кишечного тракта в виде кровотечений и аллергические реакции. Развитие службы фармаконадзора позволяет контролировать частоту таких реакций и выявлять новые, отмеченные уже при широком применении в популяции.
Введение
Быстрый прогресс в области медицины и фармации приводит к созданию современных лекарственных препаратов для лечения и контроля разных заболеваний. Однако это не решает проблемы развития нежелательных явлений (НЯ) на препараты от легких побочных эффектов до тяжелых реакций гиперчувствительности, которые могут приводить к развитию новых заболеваний, формированию временной или стойкой нетрудоспособности и смерти [1].
В практической медицине на сегодняшний день используется около 17 тыс. лекарственных средств, почти 90% из них были разработаны в последние десятилетия [2].
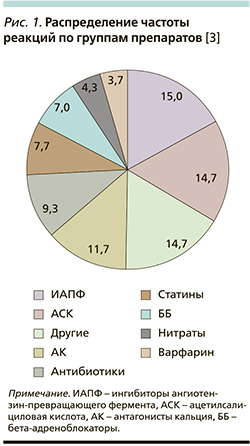
Согласно современным данным, за последние 10 лет смертность от осложнений лекарственной терапии заняла 4–6-е места в мире [3]. По разным данным, частота госпитализации по причине НЯ на прием лекарственных средств составляет от 2,4 до 12% [4].
Кроме того, развитие НЯ значительно увеличивает объем прямых и непрямых затрат на лечение пациента. Так, в США лечение пациентов с НЯ составляет в среднем 30,1 млрд долл. в год [5]. А по данным J. Sultana, средние затраты на лечение одного пациента с одним НЯ в среднем составляет 2262 долл. [6].
По данным К. Wester et al., на фоне приема лекарственных препаратов чаще всего отмечается развитие желудочно-кишечных кровотечений, кровотечений в органы центральной нервной системы, сердечно-сосудистых осложнений, других форм кровотечений, нарушения функции почек. Среди лекарственных препаратов приоритет по частоте развития НЯ принадлежит нестероидным противовоспалительным средствам (НПВС), включая низкодозированный аспирин, антидепрессантам, препаратам для лечения сердечно-сосудистой патологии [4, 7].
По данным мета-анализа Lazarou et al., проспективных исследований в 1994 г. в США НЯ на лекарственные препараты предположительно стали причиной более 100 тыс. смертей [8].
По данным M.A. Makary, чаще всего к развитию лекарственных осложнений приводят медицинские ошибки [9].
Немного истории
Первое сообщение о НЯ после анестезии хлороформом были опубликованы в журнале Lancet еще в 1848 г.
В начале XX в. в США более 100 детей погибли после употребления жидкой лекарственной формы сульфаниламидов на основе этиленгликоля, несмотря на то что тогда уже было известно об угрожающих жизни свойствах вещества. В 1938 г. после этой трагедии в Федеральный закон США FDA (Food, Drug and Cosmetic Act) было внесено требование о доказательствах безопасности нового лекарственного препарата перед его выводом на рынок [2].
 Одной из самых масштабных по своим последствиям стала талидомидовая трагедия. В 1954 г. немецкая фармацевтическая компания Chemie Grünenthal провела исследования с целью разработки бюджетного способа производства антибиотиков из пептидов. В ходе исследований работниками компании был получен препарат, названный ими талидомид (Thalidomid). Поскольку передозировка препарата во время опытов не убивала животных, это позволило считать препарат безвредным. С 1955 г. компания начала бесплатную рассылку препаратов врачам и люди, принимавшие препарат, отметили, что он оказывает успокаивающий и снотворный эффекты. В 1957 г. препарат был официально выпущен в продажу в ФРГ под названием Contergan, а затем в апреле 1958 г. – в Великобритании. Талидомид поставлялся на рынок в составе лекарственных средств для лечения астмы, снижения артериального давления, лечения мигрени, а по уровню продаж уступал разве что аспирину. Талидомид поступил в продажу в 46 стран Европы, Скандинавии, Азии, Африки, Южной Америки. При этом никаких дополнительных независимых исследований препарата нигде не проводилось. В августе 1958 г. производителям пришло письмо, в нем говорилось: «талидомид – лучшее лекарство для беременных и кормящих матерей». Это было отражено в рекламной кампании в Великобритании, хотя исследований влияния препарата на плод не проводилось. Талидомид стали широко применять для устранения бессонницы, беспокойства, тошноты, связанных с беременностью, к 1961 г. талидомид стал самым продаваемым седативным средством в ФРГ. Начиная с 1959 . в компанию Grünenthal стали поступать сообщения о развитии периферического неврита и других побочных эффектов на фоне применения талидомида. С того момента препарат начали продавать только по назначению врача. В декабре 1956 г. в семье сотрудника Chemie Grünenthal родилась дочь без ушей. Этот сотрудник давал своей беременной жене талидомид, который взял на работе еще до официального выхода талидомида в продажу. Однако связи м...
Одной из самых масштабных по своим последствиям стала талидомидовая трагедия. В 1954 г. немецкая фармацевтическая компания Chemie Grünenthal провела исследования с целью разработки бюджетного способа производства антибиотиков из пептидов. В ходе исследований работниками компании был получен препарат, названный ими талидомид (Thalidomid). Поскольку передозировка препарата во время опытов не убивала животных, это позволило считать препарат безвредным. С 1955 г. компания начала бесплатную рассылку препаратов врачам и люди, принимавшие препарат, отметили, что он оказывает успокаивающий и снотворный эффекты. В 1957 г. препарат был официально выпущен в продажу в ФРГ под названием Contergan, а затем в апреле 1958 г. – в Великобритании. Талидомид поставлялся на рынок в составе лекарственных средств для лечения астмы, снижения артериального давления, лечения мигрени, а по уровню продаж уступал разве что аспирину. Талидомид поступил в продажу в 46 стран Европы, Скандинавии, Азии, Африки, Южной Америки. При этом никаких дополнительных независимых исследований препарата нигде не проводилось. В августе 1958 г. производителям пришло письмо, в нем говорилось: «талидомид – лучшее лекарство для беременных и кормящих матерей». Это было отражено в рекламной кампании в Великобритании, хотя исследований влияния препарата на плод не проводилось. Талидомид стали широко применять для устранения бессонницы, беспокойства, тошноты, связанных с беременностью, к 1961 г. талидомид стал самым продаваемым седативным средством в ФРГ. Начиная с 1959 . в компанию Grünenthal стали поступать сообщения о развитии периферического неврита и других побочных эффектов на фоне применения талидомида. С того момента препарат начали продавать только по назначению врача. В декабре 1956 г. в семье сотрудника Chemie Grünenthal родилась дочь без ушей. Этот сотрудник давал своей беременной жене талидомид, который взял на работе еще до официального выхода талидомида в продажу. Однако связи м...












