Фарматека №6-7 / 2023
Лорлатиниб в лечении ALK-позитивного немелкоклеточного рака легкого
1) Федеральный научно-клинический центр физико-химической медицины им. акад. Ю.М. Лопухина ФМБА, Москва, Россия;
2) Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, Москва, Россия
Благодаря появлению таргетных препаратов в лечении ALK-позитивного немелкоклеточного рака легкого на сегодняшний момент стало возможным назначать пациентам лечение более эффективное и менее токсичное, чем химиотерапия. Настоящий обзор посвящен последнему из одобренных ингибиторов ALK – препарату третьего поколения лорлатинибу. Представлены данные клинических исследований, подтверждающие его эффективность как в первой, так и в последующих линиях терапии, а также место препарата в соответствии с принятыми в настоящий момент клиническими рекомендациями. Обсуждается клиническое наблюдение, демонстрирующее эффективность препарата у пациентки с ALK-позитивным немелкоклеточным раком легкого во второй линии терапии.
Введение
В 2002 г. началась эпоха таргетной терапии немелкоклеточного рака легкого (НМРЛ), когда в клинической практике стали применяться ингибиторы EGFR [1, 2].
Второй мишенью для таргетной терапии при НМРЛ стал тирозин-киназный рецептор ALK, в 2007 г. впервые описанный в качестве возможной точки приложения [3]. В случае транслокации между 2-й и 5-й хромосомами происходит прикрепление гена ALK к гену EML4, что приводит к продукции измененного рецептора ALK, не требующего лиганда для его стимуляции.
Транслокация выявляется примерно в 5% случаев НМЛР. Такая опухоль чаще имеет строение аденокарциномы и встречается у молодых некурящих пациентов. Эти характеристики не имеют существенного отличия от таковых у пациентов с мутацией EGFR, хотя в сравнительном проспективном исследовании показано, что опухоли с транслокацией ALK чаще встречаются у мужчин и пациентов более молодого возраста [4].
Тестирование на наличие транслокации ALK входит в стандарт обследования пациентов с метастатическим НМЛР. Тестирование может быть проведено несколькими методами: FISH, ИГХ, ПЦР [5].
Первый ингибитор ALK – кризотиниб – был одобрен FDA в 2011 г. после подтверждения его эффективности во второй линии лечения. Позднее препарат изучался в качестве первой линии терапии в открытом рандомизированном исследовании PROFILE 1014, опубликованном в 2014 г. [6].
В настоящий момент в РФ одобрены 4 ALK-ингибитора: кризотиниб, церитиниб, алектиниб и лорлатиниб.
Лорлатиниб – препарат третьего поколения, отличается от остальных ингибиторов ALK своей структурой: макроциклическая молекула в отличие от ациклических предшественников. Лорлатиниб преодолевает резистентность, которая развивается вследствие мутаций на фоне использования препаратов предыдущих поколений (включая наиболее частую мутацию G1202R). Более того, наличие вторичных мутаций обусловливает чувствительность опухоли к лорлатинибу [7]. Также этот препарат имеет высокую способность проникать через гематоэнцефалический барьер (ГЭБ) и не является субстратом для таких транспортных молекул, как P-гликопротеин, и таким образом способен проникать через ГЭБ благодаря своей липофильной структуре [8–10]. Такие уникальные свойства молекулы обусловливают эффективность, демонстрируемую в клинических исследованиях, в особенности при поражении головного мозга (ГМ).
Лорлатиниб во 2-й и последующих линиях терапии
Лорлатиниб – это последний из одобренных FDA ALK-ингибиторов. Впервые одобрение FDA на использование препарата во второй и последующих линиях терапии ALK-позитивного НМРЛ получено в 2018 г. после опубликованного исследования II фазы [11].
В исследование были включены 276 пациентов с подтвержденной транслокацией ALK (228 пациентов) или ROS1 (47 пациентов), один пациент был исключен из анализа до начала лечения. Из них 30 пациентов не получали ранее какого-либо лечения, остальные составляли неоднородную группу, часть из которой получала таргетную терапию, часть – химиотерапию, остальные – как таргетную, так и химиотерапию. Более подробно группы пациентов представлены в табл. 1. Пациенты имели ECOG-статус 0–2, также допускалось наличие поражения ГМ. Препарат назначался в дозе 100 мг ежедневно, объективная оценка проводилась каждые 6 недель (каждые 2 курса терапии). Первичной конечной точкой была частота объективного ответа (ЧОО), вторичными – длительность эффекта, время до реализации эффекта, выживаемость без прогрессирования (ВБП), а также безопасность.
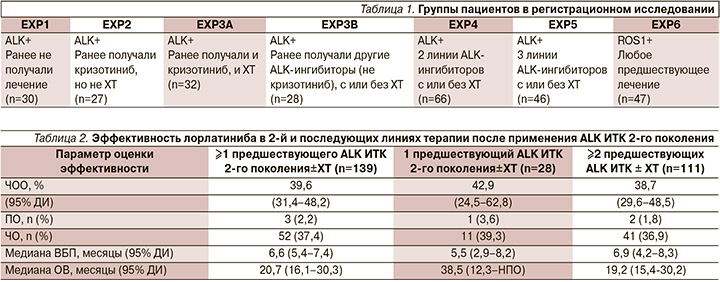
У пациентов, не получавших до этого лечения, ЧОО составила 90% (3% – полный ответ). Те пациенты, которые до включения в исследование получали только кризотиниб (с или без химитерапии), достигали ЧОО в 70% случаев (2% – полный ответ). Даже в группе, где испытуемые получали ранее 2 и более линий таргетной терапии (с/без химиотерапии), ЧОО достигли 39% больных (2% – полный ответ). В среднем ЧОО у пациентов, которые получили хотя бы одну линию терапии до включения в исследование, составила 47%, удалось обеспечить стабилизацию заболевания у 29% пациентов. Среди пациентов с поражением ГМ на момент включения в исследование ЧОО метастазов в ГМ была зарегистрирована у 63% пациентов (среди пациентов, ранее получавших только кризотиниб, – 87%), медиана длительности эффекта по метастазам в ГМ составила 14,5 месяцев. Эффективность лорлатиниба во 2-й и последующих линиях терапии после примене...












