STROKE №3 (35) / 2014
Мемантин улучшает восстановление после инсульта
Departments of Neurology and Neurobiology, David Geffen School of Medicine at UCLA; Department of Anatomy and Psychology, University of Otago, Dunedin, New Zealand; and Department of Neurology, University of Utah School of Medicine, Salt Lake City
Предпосылки и цель исследования. Лечение инсульта ограничено временны`ми окнами и клинической неэффективностью препаратов, которые казались перспективными по результатам доклинических исследований. Тем не менее данные клинических испытаний и исследований на животных свидетельствуют о наличии значительной пластичности мозга после инсульта, что оправдывает проведение лечения
с использованием препаратов, модулирующих репаративные процессы. Мемантин — антагонист рецепторов N-метил-D-аспартатглутамата, хорошо переносится и широко используется в лечении болезни Альцгеймера. Методы. Мемантин, 30 мг/кг/сут или плацебо постоянно добавляли в питьевую воду спустя 2 часа после индукции развития фототромботического инсульта. Результаты. Несмотря на отсутствие различий в размере очага инфаркта, поведении и картах оптического внутреннего сигнала в течение первых 7 дней после инсульта, у мышей, постоянно получавших мемантин, произошло значительное улучшение двигательной функции, согласно результатам теста с цилиндром и теста хождения по сетке, по сравнению с мышами, получавшими плацебо. При изучении оптического внутреннего сигнала выявили увеличении площади сенсорных карт передних лап через 28 дней после инсульта. Отметили уменьшение выраженности реактивного астроглиоза и увеличение плотности сосудов вокруг очага ишемии в головном мозге. При проведении вестерн-блоттинга тканей периинфарктной зоны обнаружили повышение экспрессии нейротрофического фактора головного мозга и рецепторов фосфорилированной тропомиозин-связанной киназы-В. Выводы. Полученные результаты показывают, что мемантин улучшает исходы после инсульта не посредством механизмов нейропротекции, а путем увеличения экспрессии нейротрофического фактора, подавления реактивного астроглиоза и улучшения васкуляризации, которые приводят к улучшению восстановления сенсорной и моторной функций коры головного мозга. Клиническая доступность и переносимость мемантина делают его привлекательным кандидатом для трансляции результатов его применения в клиническую практику.
Инсульт является четвертой по значимости причиной смерти и одной из основных причин заболеваемости во всем мире [1]. Несмотря на огромное количество исследований, вариантов лечения инсульта очень мало. Введение тканевого активатора плазминогена ограничено несколькими часами от момента появления симптомов инсульта; за пределами этого временнóго окна лечение сводится к симптоматической терапии, вторичной профилактике и реабилитации [2, 3]. В исследованиях нейропротекции, профилактика гибели клеток за пределами ядра ишемии у людей получила разочаровывающие результаты.
Тем не менее несмотря на гибель нервной ткани, после инсульта сохраняется выраженная пластичность. Модификацию процесса восстановления уже рассматривают в качестве альтернативного метода лечения и потенциально более подходящей цели в исследованиях инсульта [4, 5].
Мемантин является неконкурентным, дозозависимым антагонистом N-метил-D-аспартата, который используют в лечении болезни Альцгеймера [6, 7]. Мемантин при применении в остром периоде оказывает нейропротекторное действие, уменьшая размер очага ишемии [8–14]. Однако мемантин имеет механизмы действия, которые могут иметь большое значение за пределами острого периода [15, 16].
Мы постоянно давали мышам мемантин, используя дозы, имитирующие обычную концентрацию препарата в сыворотке крови у людей [17], не делая акцента на нейропротекцию, а изолированно изучая его влияние на репаративные процессы.
МАТЕРИАЛЫ И МЕТОДЫ
Протоколы проведения исследования были одобрены Научно-исследовательским комитетом по исследованиям на животных Калифорнийского университета, Лос-Анджелес.
Очаговая ишемия
У самцов мышей линии C57BL/6J (n=82; масса 28–32 г) инициировали фототромбоз (облучение лучом диаметром 2 мм латеральнее брегмы на 1,5 мм, с внутрибрюшинным введением через 5 минут после облучения 200 мкл раствора бенгальской розы концентрации 10 мг/мл) или проводили ложное оперативное вмешательство, как было описано ранее [4, 18]. Затем животных распределяли в группы для проведения одного из методов обследования (оценка поведения, сенсорное картирование, гистологическое исследование или вестерн-блоттинг; см. ниже) после лечения мемантином или плацебо.
Лечение мемантином
Мышей рандомизировали в группу курсового лечения мемантином в течение 28 дней (Sigma, 30 мг/кг/сут в 2%-ном растворе сахарозы) [17] или в группу лечения 2%-ным раствором сахарозы, которые постоянно добавляли в питьевую воду, начиная с 2 часов после фототромбоза. Это режим дозирования приводит к созданию концентрации мемантина в сыворотке ≈1 мкмоль/л у мышей линии C57Bl/6J, сопоставимой с терапевтической концентрацией мемантина у людей [17, 19].
Поведенческое тестирование
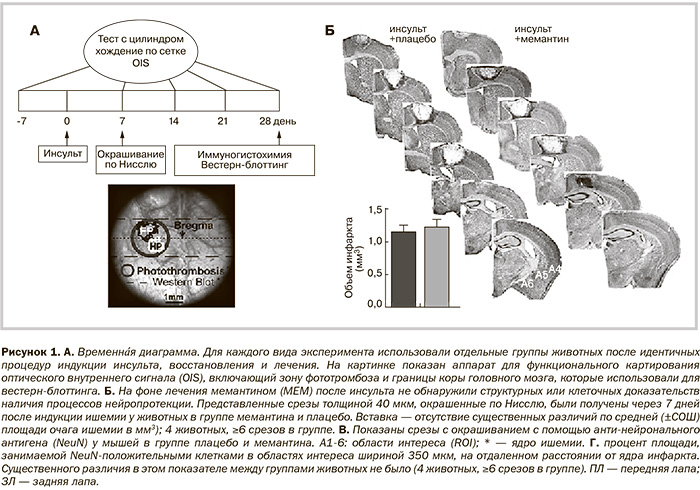
Тест с цилиндром и тест хождения по сетке проводили за 7 дней до и на 7-й, 14, 21 и 28-й дни после развития инсульта (по 8 животных в группе; рис. 1А). Видеоанализ проводили эксперты при ослеплении относительно распределения в группы лечения.
Тест с цилиндром
Записывали видео для изучения поведения животных в прозрачном акриловом цилиндре в течение 10 минут с целью оценки использования передних конечностей. Подсчитывали число касаний конечностей и рассчитывали индекс предпочтения: индекс=(левая лапка-правая лапка/левая+правая+одновременное касание) [20–22]. Тест хождения по сетке проводили в соответствии с ранее описанной методикой [4, 5]. Записывали видео для изучения передвижения мышей по приподнятой проволочной сетке в течение 5 минут. Подсчитывали число нормальных шагов и заступов каждой конечностью, рассчитывали соотношение между числом заступов и общим числом шагов.
Сенсóрное картирование
Провели визуализацию оптического внутреннего сигнала (ОВС) (по 5 животных в группе) за 7 дней до и на 7-й, 14, 21 и 28-й дни после индукции очаговой ишемии, как было описано ранее [18]. Выполняли электрическую стимуляцию (50 Гц, длительность импульса 0,001 с, ток 0,14–0,22 мА) передней и задней лап через пары подкожных игольчатых электродов с одновременной регистрацией коэффициента отражения на длине волны 617 нм через обнаженный череп. Изображения нормировали по усредненным кадрам, полученным до стимуляции. Проводили количественный расчет функциональных карт по площади, на которой пиксели показали ответ на стимул >50% максимальной реакции. Анализ изображений проводили с использованием плагинов или пользовательских процедур, написанных для программного обеспечения ImageJ [23].

Гистологическое исследование
Детальное описание методов гистологического исследования представлено в дополнительных данных on-line. Проводили транскардиальную перфузию мозга 0,9%-ным раствором хлорида натрия с последующей перфузией 4%-ным раствором параформальдегида в фосфатном буферном солевом растворе через 7 или 28 дней после фототромбоза.
Подготавливали замороженные срезы толщиной 40 мкм, как описано ранее [4, 24]. Для количественной оценки...