Эпидемиология и Инфекционные болезни. Актуальные вопросы №4 / 2017
Место ПЦР в лабораторной диагностике вирусных инфекций в рутинной практике
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Лабораторная диагностика актуальна для пациентов с иммунодефицитом. У пациентов с гемобластозами он возникает на фоне основного заболевания и из-за химиотерапии. Последняя может также влиять на патогенез вирусной инфекции.
Цель исследования. Обоснование целесообразности применения метода ПЦР в рутинной диагностике парентеральных вирусных гепатитов и герпесвирусов.
Материал и методы. Определяли лабораторные маркеры герпесвирусов, вирусов гепатитов В (ВГВ) и С (ВГС) в образцах клинического материала 997 пациентов на разных стадиях гемобластозов, протекающих с пневмонией и/или дыхательной недостаточностью и дисфункцией печени (до гепатита).
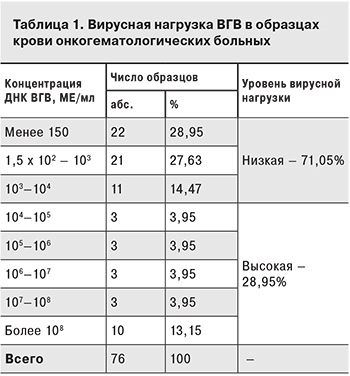
Результаты. ВГВ-инфекция ассоциирована с низкой (до 10 3МЕ/мл) виремией, ВГС-инфекция – с высокой (более 105 МЕ/мл). Применение ПЦР позволило выявить скрытые формы вирусных гепатитов, ранние стадии инфицирования и предположить вирусассоциированное поражение печени при криптогенном гепатите. ДНК герпесвирусов достоверно чаще выявляются в бронхоальвеолярной лаважной жидкости а не в крови. Поражение органов дыхания часто ассоциировано с герпесвирусами.
Заключение. ПЦР является удобным методом выявления скрытых форм вирусных инфекций у больных гемобластозами. При криптогенном гепатите исследование биоптатов печени позволило предположить вирусассоциированное поражение. Лабораторная диагностика вирусных инфекций должна носить комплексный характер.
Развитие фармацевтической промышленности в последние несколько лет позволило сильно расширить возможности терапии и профилактики вирусных заболеваний [1, 2]. Это связано, в том числе, с разработкой и внедрением новых противовирусных препаратов прямого действия, иммуномодуляторов и вакцин [2]. Однако краеугольным камнем остается своевременная, точная и быстрая лабораторная диагностика. Устойчивое развитие экспериментальной науки способствует расширению спектра используемых методов определения различных микроорганизмов и позволяет перевести некоторые из методик в область рутинной практики диагностических лабораторий [3, 4]. Лабораторная диагностика вирусных инфекций успешно применяет множество методов, которые с учетом детектируемой мишени можно условно разделить на 2 группы [5, 6]. Прямые методы основаны на выявлении компонентов вируса (антигенов, неструктурных белков или нуклеиновой кислоты), опосредованные – на определении реакции организма на присутствие вируса (антитела различных классов). Существует ряд ограничений при использовании тех или иных методов диагностики, связанных как с особенностями патогена, так и с состоянием организма пациента. Наиболее часто используемым и доступным материалом для исследования является кровь. Однако прямые диагностические методы могут быть малоэффективными в случаях, если имеет место локальная репликация вируса, когда зрелые вирионы не попадают в кровоток [7, 8]; элиминация вируса; изменения в структуре компонентов вирионов в результате мутаций [9]; изменение сценария, по которому развивается патогенетический процесс (скрытая форма гепатита В) [10–15]; цитопения или уменьшение числа клеток-мишеней для репликации лимфотропных вирусов [16–22].
Опосредованные методы также имеют ряд ограничений. Например, наличие гипогаммаглобулинемии у пациента может приводить к неэффективной серологической диагностике из-за нарушения синтеза иммуноглобулинов разных классов [18]. С другой стороны, применение внутривенных препаратов иммуноглобулинов, напротив, теоретически может приводить к гипердиагностике. Таким образом, очевидно, что подход к лабораторной диагностике вирусных инфекций должен быть комплексным.
Своевременное выявление вирусной инфекции особенно актуально для пациентов, находящихся в состоянии первичного или вторичного иммунодефицита. К таким пациентам относятся, в первую очередь, ВИЧ-инфицированные, больные онкологического и онкогематологического профиля, реципиенты костного мозга, органов и тканей, и беременные женщины [4, 7, 16–25]. Пациенты с гемобластозами находятся в состоянии иммунодефицита как на фоне течения основного заболевания (угнетения нормального кроветворения), так и за счет проводимой химиотерапии [7, 24]. У них страдают как клеточное, так и гуморальное звено иммунитета, что может приводить к низкому уровню или практически полному отсутствию иммуноглобулинов [24]. Еще одной проблемой лабораторной диагностики является изменение патогенетического процесса вирусной инфекции на фоне массивной цитостатической терапии [8, 10–13, 15].
 Суммируя вышесказанное, можно выделить 3 основные причины ложноотрицательных результатов вирусологического исследования у пациентов с угнетенным иммунитетом: низкая репликативная активность вируса; патогенез инфекции на фоне измененного состояния иммунитета; «негативное окно». Также нельзя забывать о влиянии человеческого фактора, который зачастую нивелируется автоматизацией лабораторных процессов. На сегодняшний день опубликовано много работ, описывающих изменения патогенеза инфекций, вызванных вирусами гепатитов В (ВГВ) и С (ВГС) [8, 10–13, 15]. Одно из них характеризуется транзиторным характером выявления различных компонентов вириона или антител к вирусным белкам в кровотоке. Например, стандартный маркер ВГВ – поверхностный антиген (HBsAg) – может периодически не определяться в крови больных хронической формой инфекции даже в фазе обострения [10, 11, 13]. Проблемой является широкое распространение скрытых форм ВГВ и ВГС [10–12, 15].
Суммируя вышесказанное, можно выделить 3 основные причины ложноотрицательных результатов вирусологического исследования у пациентов с угнетенным иммунитетом: низкая репликативная активность вируса; патогенез инфекции на фоне измененного состояния иммунитета; «негативное окно». Также нельзя забывать о влиянии человеческого фактора, который зачастую нивелируется автоматизацией лабораторных процессов. На сегодняшний день опубликовано много работ, описывающих изменения патогенеза инфекций, вызванных вирусами гепатитов В (ВГВ) и С (ВГС) [8, 10–13, 15]. Одно из них характеризуется транзиторным характером выявления различных компонентов вириона или антител к вирусным белкам в кровотоке. Например, стандартный маркер ВГВ – поверхностный антиген (HBsAg) – может периодически не определяться в крови больных хронической формой инфекции даже в фазе обострения [10, 11, 13]. Проблемой является широкое распространение скрытых форм ВГВ и ВГС [10–12, 15].
Выбор метода диагностики в зависимости от ситуации позволяет уменьшить число ложноотрицательных результатов тестирования. Применение полимеразной цепной реакции (ПЦР) позволяет сократить период «негативного окна»: для ВГВ – до 30 дней от момента инфицирования (HBsAg выявляется на 21 день позже), для ВГС – до 11 дней (антитела к белкам вируса появляются на 42–70 дней позже), для герпесвирусов – до 7–10 дней от момента реактивации (вирусспецифические ДНК определяются в мононуклеарной фракции клеток периферической крови, антитела выявляются на 21–30 дней позже).
Практика гематологического стационара в последние десятилетие показала необходимость увеличения числа используемых лабораторных методов [7, 8, 17, 25]. При подозрении на ВГВ-инфекцию необходимо тестировать кровь пациентов с угнетенным иммунитетом и реципиентов множественных трансфузий не только на HBsA...












