Фарматека №7 (320) / 2016
Моноклональные антитела в терапии псориаза и псориатического артрита
ГК «Медси», Москва
Представлены клинические данные о возможности применения в лечении псориаза и псориатического артрита моноклональных антител (МА): их структуре, механизме действия, дозировках и путях введения. Препараты разделены на группы, согласно результатам их сертификации. Проанализированы данные международных исследований эффективности и переносимости МА при разных нозологиях, а также результаты собственных клинических наблюдений. Представлены практические рекомендации по применению МА при псориазе и псориатическом артрите.
Создание биологических модификаторов иммунного ответа (biologics) стало революцией в медицине – впервые появились препараты, производимые с помощью рекомбинантной ДНК, действие которых нацелено на конкретные звенья патогенеза заболеваний. Целенаправленность специфического воздействия на иммунную систему, высокая эффективность, хорошая переносимость и комплаентность обусловили широкое распространение биолоджиков в самых разных областях медицины, в т.ч. в дерматологии.
Для лечения псориаза и псориатического артрита (ПА) применяют все три группы биологических модификаторов иммунного ответа: антитела, слитые белки, рекомбинантные человеческие цитокины и факторы роста, но наибольшее распространение получили препараты, нацеленные на блокаду специфических рецепторов на поверхности иммунокомпетентных клеток или провоспалительных цитокинов – моноклональные антитела (МА). Мы разделили указанные медикаменты на группы согласно результатам их сертификации в России, Европе и США (табл. 1).
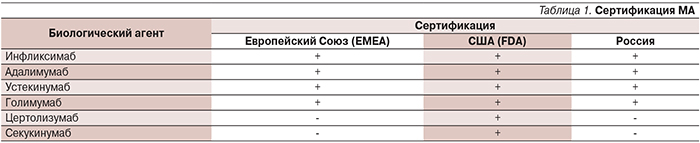
МА, разрешенные к широкому применению в России
Адалимумаб
Адалимумаб – рекомбинантные МА, пептидная последовательность которых идентична иммуноглобулину (Ig) G1 человека. Препарат селективно связывается с фактором некроза опухоли α (ФНО-α) и нейтрализует его биологические функции за счет блокады взаимодействия с поверхностными клеточными р55- и р75-рецепторами. Адалимумаб изменяет уровни молекул адгезии, вызывающих миграцию лейкоцитов, быстро снижает уровни острофазных показателей воспаления (С-реактивного белка и СОЭ), сывороточных уровней цитокинов (интерлейкина-6 [ИЛ-6]), сывороточной активности матриксных металлопротеиназ (ММР-1 и ММР-3), вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща [1].
Адалимумаб вводят подкожно в область живота или переднелатеральную область бедра исходно в дозе 80 мг, через 1 неделю – 40 мг, далее – по 40 мг 1 раз в 2 недели.
 ПА – основное показание к назначению адалимумаба. Препарат был разрешен к применению в практическом здравоохранении в 2005 г. для лечения активного ПА в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами на основании результатов международного рандомизированного плацебо-контролируемого клинического исследования ADEPT [2].
ПА – основное показание к назначению адалимумаба. Препарат был разрешен к применению в практическом здравоохранении в 2005 г. для лечения активного ПА в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами на основании результатов международного рандомизированного плацебо-контролируемого клинического исследования ADEPT [2].
Псориаз. В 2008 г. Food and Drug Administration (FDA – Управление по контролю за пищевыми и лекарственными средствами) США одобрила применение препарата при бляшечном псориазе после двойного слепого плацебо-контролируемого многоцентрового международного исследования REVEAL, в котором участвовали свыше 1200 пациентов в течение года [3, 4].
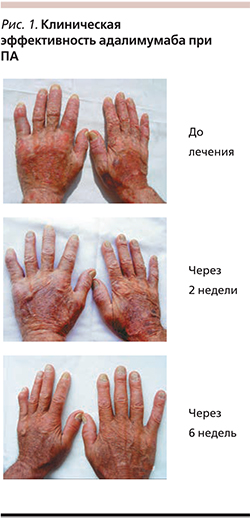
Под нашим наблюдением адалимумаб в качестве монотерапии получали 19 больных ПА: 11 женщин и 8 мужчин. Поражение суставов у всех пациентов сопровождалось распространенными высыпаниями и поражением ногтей. Возраст пациентов колебался от 22 до 62 лет, длительность псориаза – от 10 до 33, ПА – от 3 до 27. Предшествовавшая терапия для всех пациентов была недостаточно эффективной. Препарат вводили согласно инструкции. У всех больных уже через 3–7 дней уменьшалась скованность суставов. Через месяц по критерию ACR-20 ответили 10 человек, ACR-50 – 5, ACR-70 – 3; через 12 недель – 2, 6 и 12 пациентов соответственно. Клинический пример представлен на рис. 1. Все пациенты достигли PASI-75 (улучшение индекса PASI более чем на 75%) через 12 и 40 недель. Переносимость препарата в целом по группе была хорошей, серьезных побочных эффектов не зарегистрировано.
Голимумаб
Голимумаб – полностью человеческие МА к ФНО-α – последний внедренный в клиническую практику ингибитор ФНО-α.
Вводят подкожно по 50 или 100 мг 1 раз в месяц [5].
ПА. Голимумаб одобрен FDA для лечения ПА на основании исследования III фазы GO REVEAL, в котором участвовали 405 пациентов в течение 14 недель [6]. К 14-й неделе лечения терапевтический эффект ACR-20 был достигнут у 51% больных, получавших препарат в дозе 50 мг, и у 41% — в дозе 100 мг по сравнению с 9% в группе плацебо. По индексам ACR-50 и ACR-70 у пациентов, принимавших голимумаб, также отмечено значительное улучшение по сравнению с группой плацебо.
Препарат разрешен к применению в комбинации с метотрексатом или в качестве монотерапии при активном прогрессирующем ПА, когда другие методы лечения оказались неэффективными.
Псориаз. W.K. Lee и соавт. (2015) [7] описали успешное лечение голимумабом в дозе 50 мг/мес пациента, страдавшего псориатической эритродермией.
Инфликсимаб
Инфликсимаб – селективный антагонист ФНО-α, представляющий собой химерные МА IgG1, которые на 75% состоят из человеческого и на 25% из мышиного белка. Инфликсимаб связывается с ФНО-α с высокими специфичностью, аффинностью и авидностью, образует стабильные комплексы с ФНО-α, подавляет биологическую активность свободного и мембран-ассоциированного ФНО-α, не взаимодействует с лимфотоксином (ФНО-β), лизирует (или индуцирует апоптоз) ФНО-продуцирующих клеток [8].
Инфликсимаб вводят ...












