Урология №3 / 2018
МпМРТ/УЗИ fusion-биопсия в диагностике рака предстательной железы. Наш опыт
ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России (Сеченовский Университет), Москва, Россия
Введение.Рак предстательной железы – одно из самых распространенных онкологических заболеваний у мужчин. «Золотым» стандартом верификации рака простаты на сегодняшний день является трансректальная биопсия простаты под ультразвуковым контролем. Выявляемость рака при данном методе составляет от 30 до 50%. В связи с этим происходит прогрессирующее увеличение повторных биопсий при сохраняющемся подозрении на рак простаты. Европейское общество урологов не дает никаких рекомендаций по этому поводу. Революционно новым методом в диагностике рака простаты становится выполнение биопсии предстательной железы под контролем fusion-навигации. Материал и методы. В клинике урологии им. Р. М. Фронштейна 55 пациентам с подозрением на рак простаты с сентября 2017 по январь 2018 г. была проведена fusion-биопсия предстательной железы. Отрицательную первичную биопсию имел 21 пациент. У 2 пациентов был верифицированный рак предстательной железы. Первичным биопсиям 32 пациента не подвергались.
Результаты. По результатам данных проведенных fusion-биопсий было установлено, что выполнение биопсии простаты под контролем fusion-навигации улучшает качество гистологического материала, избавляет пациента от лишних биопсий, уменьшает количество пункций при данной манипуляции, тем самым выводит диагностику РПЖ на более высокий уровень. МпМРТ/УЗИ-таргетная биопсия обладает высокой чувствительностью в выявлении клинически значимого рака и низкой – клинически незначимого.
Заключение. Методика позволяет определять локализацию и распространенность патологических изменений в простате, что расширяет возможности применения фокальной терапии РПЖ.
Введение. Рак предстательной железы (РПЖ) – второе по частоте выявления онкологическое заболевание у мужчин в мире. В 2012 г. РПЖ диагностирован у 1,1 млн человек, что составляет 15% от всех случаев рака [1]. Частота аутопсийно выявленного РПЖ примерно одинакова повсеместно [2].
Согласно А. Д. Каприну и соавт. [3], доля РПЖ в России составляет 14,3% среди всех онкозаболеваний у мужской части населения, что выводит данную нозологию на второе место после бронхогенной карциномы. В возрастной же категории старше 60 лет РПЖ занимает первое место по встречаемости и составляет 18,5% от всех случаев онкозаболеваний.
Выявляемость рака при стандартной трансректальной биопсии простаты составляет от 30 до 50%. В связи с этим происходит прогрессирующее увеличение повторных биопсий при сохраняющемся подозрении на рак простаты [4].
На сегодняшний день биопсия, выполняемая под УЗ-контролем, является «золотым» стандартом рака предстательной железы. В большинстве случаев биопсия проводится трансректально, реже – трансперинеально. Выявляемость РПЖ при использовании обеих техник сопоставима [5, 6]. Частота выявления РПЖ при первичной трансректальной биопсии под УЗ-контролем варьируется от 30 до 50% [7].
По данным рекомендаций Европейского общества урологов (2017), показанием к повторной биопсии простаты служат повышение уровня ПСА; наличие подозрительных признаков при ПРИ (риск наличия рака – 5–30%); наличие атипичной мелкоацинарной пролиферации (риск наличия рака – 40%); наличие ПИН высокой степени (риск наличия рака – 30%); наличие атипичных желез, непосредственно прилегающих к ПИН (риск наличия рака – 50%); внутрипротоковая карцинома как солидная находка (риск наличия рака – 90%); наличие подозрительного участка на мультипараметрической магнитно-резонансной томографии (мпМРТ).
Отмечается прогрессирующее увеличение количества повторных (вторичных, третичных) биопсий простаты, которые не выявляют злокачественного процесса. На сегодняшний день Европейское общество урологов не дает рекомендаций по ведению таких пациентов.
Частота РПЖ, диагностируемого при сатурационной повторной биопсии (>20 точек), составляет 30–43% и зависит от количества пункций предыдущих биопсий [8]. Сатурационная повторная биопсия может выполняться трансперинеальным доступом, что позволяет обнаруживать рак в 38% случаев, однако существует риск (10%) развития осложнения в виде задержки мочи [9].
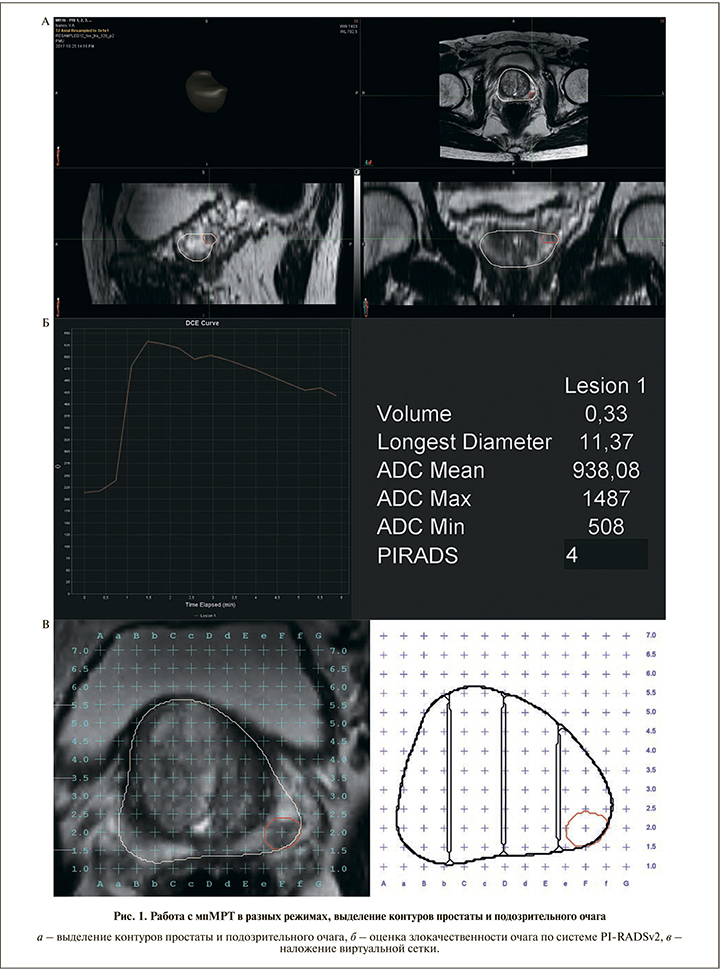
С целью улучшения качества диагностики РПЖ, избавления пациентов от повторных биопсий, уменьшения количества пункций при биопсии разработана и успешно введена в клиническую практику новая методика высокоточной диагностики рака – биопсия предстательной железы под контролем fusion-навигации (от англ. fusion – слияние) [10–12]. Данная запатентованная технология основана на совмещении двух модальностей, мультипланарной магнитно-резонансной томографии (мпМРТ) и УЗИ, что позволяет в режиме реального времени выполнять прицельную биопсию предстательной железы из подозрительных участков. Кроме того, методика позволяет не просто констатировать наличие или отсутствие злокачественного процесса, но и дает возможность оценить локализацию и распространенность процесса в простате, что в свою очередь расширяет возможности дальнейшего использования фокальной малоинвазивной терапии РПЖ и позволяет избегать необоснованных радикальных простатэктомий [13].
Предбиопсийная МРТ при таргетной биопсии
Для интерпретации подозрительного на рак участка используется система унифицированного подхода PI-RADSv2 [14]. Данная система подразумевает, что МРТ-исследование должно включать Т2-взвешенные (Т2-ВИ), диффузно-взвешенные (ДВИ) изображения и серии динамического контрастного усиления. Диффузно-взвешенные изображения следует получать с использованием высокого b-показателя в диапазоне от 1400 до 2000 с/мм2 и с реконструкцией карт измеряемых коэффициентов диффузии. PI-RADSv2 характеризует каждый выявленный подозрительный на клинически значимый рак очаг по шкале от 1 до 5 баллов в соответствии с изменениями в каждом сегменте железы, согласно доминирующей импульсной последовательности и другим импульсным последовательностям в порядке убывания их значимости для интерпретации в...












