Вестник Российского общества урологов №1 / 2019
Новые возможности в лечении локализованного рака предстательной железы
Отделение высокотехнологичной медицинской помощи Европейского медицинского центра, Москва
По последним данным в структуре заболеваемости среди мужского населения за 2018 г. злокачественные новообразования предстательной железы продолжают занимать лидирующие позиции. Так, в США, Канаде и в ряде стран Европы они выходят на 1-е место, в России – на 2-е (прирост заболеваемости с 2006 по 2016 г. составил 87,11% при среднем темпе прироста за 2016 г. 5,89%) [1].
Причем процент выявления рака предстательной железы на ранних стадиях (I–II) на данный момент значительно выше, чем распространенных форм (III–IV), что связано с совершенствованием диагностики и скринингом мужчин после 50 лет [2, 3]. Этот факт диктует необходимость внедрения новых современных подходов и стратегий в ведении данных пациентов.
На настоящий момент в мире разработана стратификация пациентов по прогнозу и ожидаемой продолжительности жизни, что помогает уйти от устаревших стандартов и подобрать индивидуальное лечение без нарушения качества жизни пациентов (табл. 1) [4].
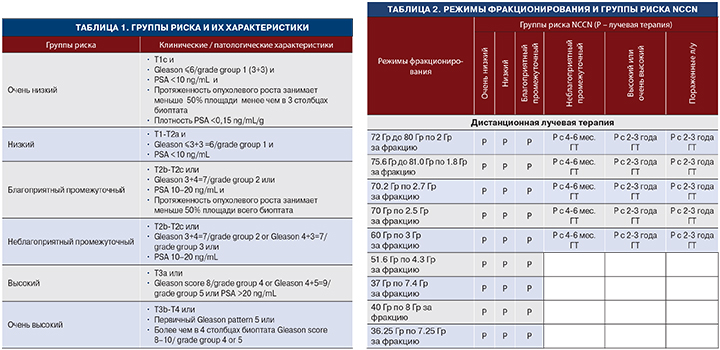
Так, для лечения рака предстательной железы у пациентов с низким и промежуточным риском, ранее считавшаяся «золотым стандартом» радикальная простатэктомия становится неоправданной, постепенно вытесняясь другими методами.
Согласно данным Европейской ассоциации урологов, радикальная простатэктомия может сопровождаться развитием осложнений, которые ухудшают качество жизни пациентов. К ним относятся...












