Терапевтический справочник. Путеводитель врачебных назначений №2 (5) / 2017
ОБСТРУКТИВНОЕ АПНОЭ СНА
ФГБОУ ВО «МГМСУ им. А.И. Евдокимова Минздрава России»
По данным популяционных исследований, в современном мире обструкционное апноэ сна диагностируется примерно у 10% взрослых людей. При наличии же у пациентов сердечно-сосудистых патологий, приводящих к задержке в организме натрия и воды, распространенность этого заболевания возрастает до 50 — 83%.
Обструктивное апноэ сна (ОАС) – гетерогенное парасомническое (возникающее во сне) заболевание, характеризующееся рядом типичных признаков, варьирующих по времени и интенсивности в зависимости от тяжести болезни:
- глоточными коллапсами и дыхательными паузами более 10 секунд, с сохраненными дыхательными усилиями;
- частыми ночными десатурациями (падениями насыщения артериальной крови кислородом);
- наличием характерных дневных проявлений (избыточная сонливость, артериальная гипертензия, сердечные аритмии, инсулинорезистентность, метаболические нарушения).
Код по Международной классификации болезней 10-го пересмотра (МКБ 10):
- G 47.3 — апноэ во сне (центральное, обструктивное).
ЭПИДЕМИОЛОГИЯ
Только за последние 30 лет количество пациентов с обструктивным апноэ сна (ОАС) в мире увеличилось более чем в 10 раз. В развитых странах средний возраст установления диагноза ОАС за указанный период снизился с 62 до 35 лет. При этом в общей популяции пациентов на 42% увеличилась доля женщин.
Существуют убедительные доказательства причинно-следственной связи ОАС с артериальной гипертензией (АГ), ишемической болезнью сердца, сердечной недостаточностью, мерцательной аритмией и инсультом. Неудивительно, что в большинстве случаев ОАС рассматривается как независимый предиктор преждевременной сердечно-сосудистой смерти. Так, более 78% пациентов ОАС погибают от фатальных сердечно-сосудистых осложнений.
Наблюдения последних лет показывают, что пациенты ОАС тяжелого течения в 4,8 раза чаще умирают от онкологических заболеваний.
ЭТИОЛОГИЯ И КЛАССИФИКАЦИЯ
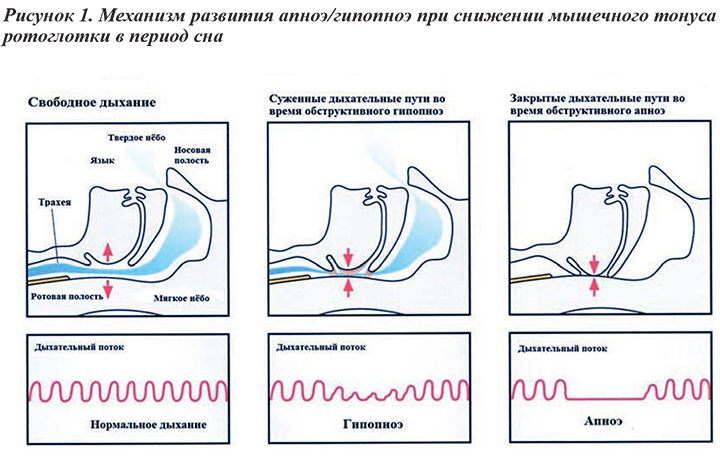
По современным представлениям, этиология ОАС связана с причинами развития глоточных коллапсов во время сна (рис.1), которые могут происходить как у здоровых лиц, так и у пациентов с ожирением, инсулинорезистентностью, метаболическими нарушениями, сердечно-сосудистыми и легочными заболеваниями.
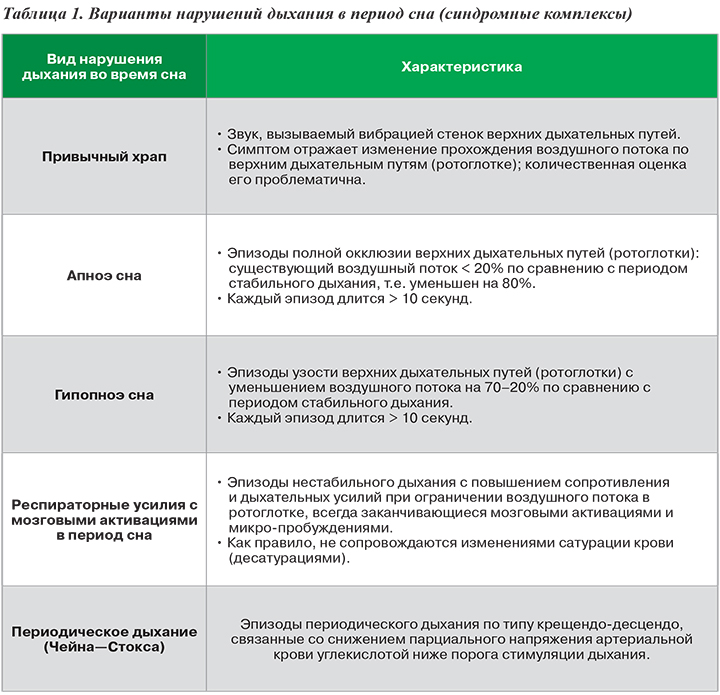
Выделяют различные варианты нарушений дыхания в период сна: помимо собственно апноэ сна, они включают еще 4 различных синдромных комплекса (табл. 1) .
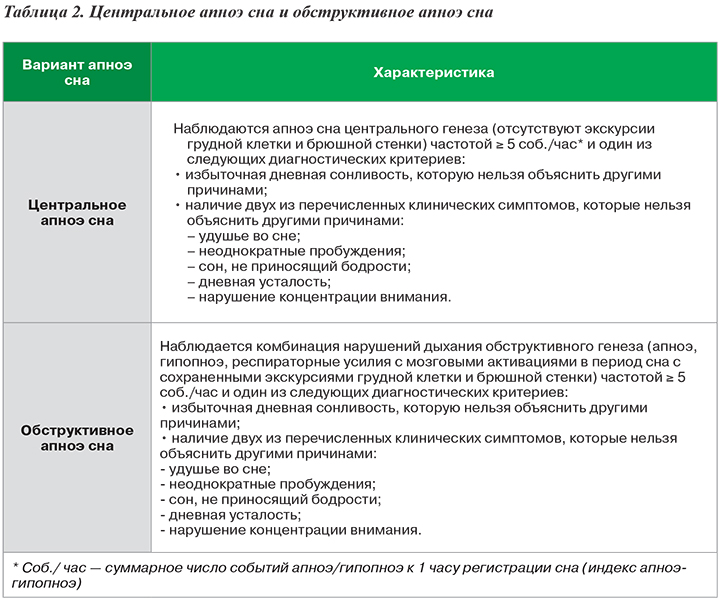
Что же касается самого парасомнического заболевания в виде апноэ сна (остановки дыхания во сне), то его классифицируют на обструктивное апноэ сна и центральное апноэ сна (табл. 2).
Тяжесть заболевания описывается индексом апноэ-гипопноэ (ИАГ) — суммарным числом событий узости (гипопноэ) и окклюзии (апноэ) глотки (соб.) к 1 часу регистрации сна:
- ИАГ свыше 5 соб./час — начало болезни;
- ИАГ 5-15 соб./час — легкое течение заболевания:
- ИАГ 15-30 соб./час — среднетяжелое течение;
- ИАГ > 30 соб./час — тяжелое течение.
Гендерный фактор
В крупномасштабных международных исследованиях (Буссельтон, 1995 г., Пенсильвания, 2001 г., Висконсин, 2008 г.) с участием взрослых лиц среднего возраста распространенность ОАС среди мужчин значительно превышала таковую среди женщин (25,9 против 5,5%). Самая низкая частота апноэ сна выявляется у женщин фертильного возраста с резким ее нарастанием после менопаузы.
Установлена крайне высокая распространенность ОАС среди женщин с синдромом поликистозных яичников (49,5%). Встречаемость заболевания среднетяжелого течения у женщин в период постменопаузы в 4 раза превышала таковую у женщин в период пременопаузы, что нельзя объяснить только возрастным фактором.
Сон и сужения ротоглотки
Фарингальный коллапс, сопровождающийся храпом, считается основной проблемой пациентов ОАС. Особенностью коллапса является его развитие во время глубокого сна и сновидений. Дыхательное усилие в такие периоды не регулярно. В результате уменьшения нейрогенного контроля активности двигательных нейронов верхних дыхательных путей (ВДП) наблюдается снижение активности мышц-дилататоров и развитие узости. Незначительное сужение ротоглотки (гипопноэ, респираторные усилия с мозговыми активациями в период сна) способно полностью прекратить эффективную вентиляцию.
Наибольшая выраженность таких событий наблюдается при недостатке серотонина 2А (5-НТ2А). При этом, к сожалению, рецепторы для агонистов 5-НТ2А не могут рассматриваться как перспективная фармакологическая мишень, т.к. активация других нейронных путей приводит к существенным побочным эффектам у пациентов с ОАС.
Кардиоваскулярный и метаболический факторы
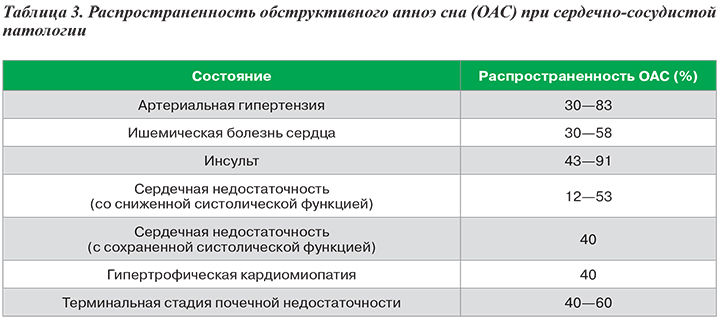
За последние 20 лет увеличение числа людей с ожирением и чрезмерным потреблением воды и натрия существенно повысило распространенность ОАС в общей популяции, в особенности среди пациентов с сердечно-сосудистыми заболеваниями (табл. 3).
Существуют взаимные связи между частотой апноэ сна и кардиоваскулярными заболеваниями. Так, встречаемость АГ у пациентов с ОАС варьирует от 35 до 80% и коррелирует с тяжестью апноэ сна. Более ...












