Фарматека №13 (246) / 2012
Обоснование и тактика назначения в медицинской практике различных форм пробиотических препаратов
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва
Статья посвящена оценке терапевтической эффективности пробиотиков, определяемой особенностями штаммов, на основе которых производится препарат, и конечной формой его выпуска. Отмечено, что терапевтический эффект пробиотика тесно связан с научным обоснованием выбора производственных штаммов, фенотипических и молекулярно-генетических свойств, определяющих безопасность, иммуномодулирующее действие препарата, адгезию и сроки выживания микроорганизма в интродуцируемом организме. Лекарственная форма способствует реализации пробиотических свойств препарата, оцениваемых в двойных слепых плацебо-контролируемых клинических испытаниях. Отдельное внимание уделено характеристике различных форм пробиотических комплексов Бифиформ, которые предназначены для разных возрастных групп и эффективных при лечении и профилактике дисбиотических состояний.
Введение
Назначение пробиотических препаратов (ПП) с профилактической или лечебной целью подразумевает непосредственную коррекцию нарушенной нормальной микрофлоры человека. Высокая частота возникновения дисбиотических состояний различного генеза среди детей и взрослого населения России определяет существенную потребность практической медицины в препаратах, корригирующих нарушенную нормальную микрофлору кишечника человека. Нормофлора, или микробиота, человека представляет собой эволюционно сложившуюся экологическую систему разнообразных микроорганизмов, населяющих открытые полости организма и поддерживающих биохимическое, метаболическое, иммунологическое равновесие, необходимое для сохранения здоровья [8]. Микробные сообщества образуют биоценоз определенного биотопа и вместе с организмом хозяина формируют постоянные или временные экосистемы. Внутри экосистем популяции и сообщества микроорганизмов занимают свои экологические ниши, колонизируя слизистые облочки (СО) в виде бактериальных биопленок.
Методами сканирующей и трансмиссионной электронной микроскопии установлено, что биопленки однородных и смешанных микробных сообществ различных видов энтеробактерий и стафилококков, развивающиеся in vivo или in vitro на агаризованной среде, идентичны по своему строению. Поверхностные структуры биопленок экранируют клетки, обеспечивают их контакт с внешней средой, повышают их устойчивость к различным повреждающим факторам. Идентичность ультратонкого строения биопленок, развивающихся на биотических или абиотических поверхностях, свидетельствует об универсальности защиты микробных клеток индигенной микрофлоры, что является важным свойством для гомеостаза макроорганизма, функциональная активность которого тесным образом связана с населяющими его желудочно-кишечный тракт (ЖКТ) сообществами микроорганизмов. Фрагменты бактерильных биопленок представлены на рис. 1, 2.
Хорошо известна важная роль иммунной системы СО и ассоциированной с ней лимфоидной ткани в осуществлении барьерного и иммунорегуляторного гомеостаза макроорганизма. Поверхности СО покрыты слоем эпителиальных клеток и слизью, предотвращающими попадание экзогенных антигенов в организм. Эпителиальные клетки формируют физический барьер за счет движения ресничек, продукции слизи, секреции молекул с антибактериальной и цитолитической активностью (дефенсины, лактоферрин, лизоцим и др.). В совокупности эти врожденные механизмы в ассоциации с нормальной микрофлорой обеспечивают первую линию защиты против возбудителей инфекционных заболеваний, чужеродных антигенов и аллергенов. Иммунный ответ СО кишечника обеспечивается защитной системой, известной как GALT (gut-associated lymphoid tissue – лимфоидная ткань, ассоциированная с ЖКТ), которая начинает обнаруживаться в ЖКТ c первых дней жизни ребенка и после периода сукцессии (смены сообществ), занимающего, по данным различных исследователей, до двух лет, становится полностью сформировавшейся [14, 17, 27].
GALT выполняет три важнейшие функции:
• защищает СО от колонизации и инвазии потенциально опасными патогенами;
• препятствует захвату нерасщепленных антигенов, включая белки перевариваемой пищи и микроорганизмы комменсалы;
• предотвращает развитие потенциально вредного иммунного ответа на эти антигены.
В GALT принято выделять два участка: индуктивный (лимфоидная ткань) и эффекторный (непосредственно СО). В индуктивной зоне протекают процессы иммунологического распознавания, презентации антигена при участии макрофагов и дендритных клеток, формируется популяция антигенспецифических лимфоцитов. В эффекторной зоне происходит реализация иммунного ответа при участии Т- и В-лимфоцитов и антител внешних секретов. При определенных условиях иммунный ответ может быть индуцирован и в интерстициальном эпителии [27].
Существуют специфические Tolllike-рецепторы (TLR), которые можно назвать сигнальными. Они распознают чужеродные консервативные структуры (лиганды), оповещают об их приходе и запускают каскад реакций, обеспечивающих активацию транскрипционного ядерного фактора κB. Активация NF-κB представлена на схеме, адаптированной по А.Н. Маянскому и соавт. (рис. 3) [16].
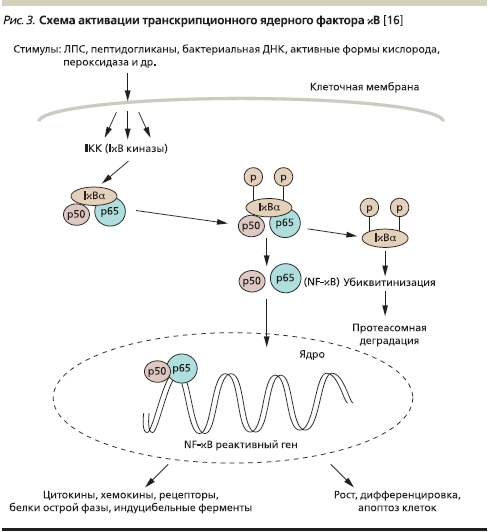
Кроме того, происходит образование ряда соединений, главной функцией которых является обеспечение реакций врожденного иммунитета. В то же время реакции, индуцированные TLR, способствуют развитию адаптивного иммунитета [7, 13].
Микробные сообщества образуют биоценоз определенного биотопа и вместе с организмом хозяина формируют постоянные или временные экосистемы. Внутри экосистем популяции и сообщества микроорганизмов занимают свои экологические ниши. Наибольшее внимание врачей, ученых и широких кругов общественности привлекает в настоящее время кишечный микробиоценоз, т. е. совокупность микробного населения кишечника [8, 23]. Это один из наибо...












