Клиническая Нефрология №4 / 2015
Оценка антипротеинурического действия препарата, блокирующего эффекты моноцитарного хемотаксического протеина-1, у больных хроническим гломерулонефритом
1 ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» МЗ РФ 2 ФГБУ «Российский кардиологический научно-производственный комплекс» МЗ РФ, Институт экспериментальной кардиологии, Москва
Цель исследования. Оценить эффективность, безопасность и переносимость отечественного препарата, ингибирующего действие МСР-1, у больных протеинурическими формами хронического гломерулонефрита.
Материал и методы. В исследование включены 7 больных различными морфологическими вариантами ХГН. У всех пациентов отмечено активное течение нефрита: у 3 – выраженный НС с сохранной функцией почек и умеренной артериальной гипертензией, у 4 – выраженный мочевой синдром с персистирующей протеинурией, эритроцитурией, у 3 – с начальным снижением СКФ 62–74 мл/мин (ХБП 2-й ст.). Курс лечения препаратом состоял из 6 инъекций в неделю с интервалами 6 часов между двумя первыми, 24 часа между последующими двумя, 48 часов между пятой и шестой инъекциями. Шести пациентам через 4 недели курс лечения повторили. Исследование мочевой экскреции МСР-1 и TФР-β1 проведено методом ELISA (МСР-1 Bioscience, Austria, TGF-beta1 Invitrogen, USA), определение уровня интерлейкина-8 в сыворотке крови – методом Immulite.
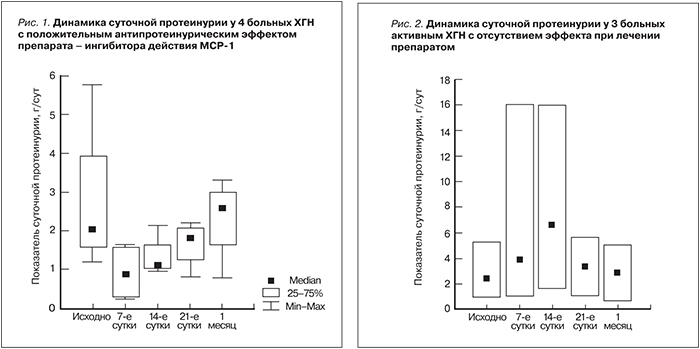
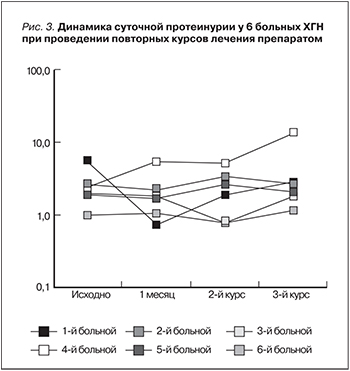
Результаты. У 4 из 7 больных ХГН на 7–14-е сутки лечения препаратом отмечено уменьшение протеинурии, однако антипротеинурический эффект сохранялся в течение месяца. У 3 из 7 обследованных пациентов в те же сроки наблюдения, напротив, отмечено нарастание протеинурии с резким увеличением уровня МСР-1 в моче и ИЛ-8 в сыворотке крови («цитокиновый» рикошет) и снижением мочевого показателя TФР-β. Дальнейшее исследование препарата было прекращено в связи с низкой эффективностью и отсутствием стойкого эффекта.
Заключение. Изученный препарат оказывает быстрое антипротеинурическое действие, однако отсутствие стойкого эффекта ограничивает его применение пациентами с активными формами ХГН. Разработка пролонгированных форм ингибиторов МСР-1 и оценка эффекта в комбинации со стандартной иммуносупрессивной терапией остаются перспективным направлением для дальнейшего исследования.
Лечение хронического гломерулонефрита (ХГН) является одной из актуальных проблем в нефрологии, что определяется распространенностью данной патологии (диагностируется у трети всех пациентов с заболеваниями почек), тяжестью течения и недостаточной эффективностью стандартных схем терапии определенных форм ХГН с неизбежным прогрессированием в хроническую почечную недостаточность (ХПН).
В механизмах прогрессирования ХГН особое значение придают моноцитарному хемотаксическому протеину-1 (MCP-1), что показано на воспалительных [1] и невоспалительных [2, 3] моделях почечного повреждения у животных. В клинических исследованиях, в т.ч. отечественных, продемонстрирована связь уровня МСР-1 в моче с клиническими и гистологическими признаками активности нефрита, а также с распространенностью тубулоинтерстициального фиброза (ТИФ) [4, 5].
Данный хемокин секретируют мезангиальные, эндотелиальные клетки почки, подоциты, а также клетки тубулярного эпителия, в т.ч. в ответ на воздействие компонентов протеинурии (ПУ) [6, 7]. МСР-1 является основным хемоаттрактантом для мононуклеарных клеток и играет ключевую роль в формировании воспалительного инфильтрата в ткани почки [1, 8].
Введение нейтрализующих антител к МСР-1 мышам с экспериментальным нефритом приводило к уменьшению ПУ, инфильтрации клубочков макрофагами и препятствовало развитию гломеруло- и тубулоинтерстициального фиброза [9, 10]. У пациентов с нефритом отмечен антипротеинурический и ренопротективный эффекты ингибиторов МСР-1 за счет нивелирования неблагоприятных эффектов этого цитокина на подоциты [11, 12].
В ФГБУ РКНПК МЗ РФ разработан препарат, представляющий собой пептид Х молекулы МСР-1 (65–76 МСР-1). Противовоспалительное действие препарата обусловлено связыванием с гликозаминогликанами на поверхности клеток, вытеснением эндогенного МСР-1 и, возможно, других хемокинов. В моделях локального воспаления у различных животных (линейных мышей и крыс, а также у обезьян) препарат при внутримышечном и внутривенном введении ингибировал миграцию моноцитов и гранулоцитов в участки воспаления.
Доклиническое изучение фармакологического и токсикологического действий препарата показало его безопасность в рекомендованных дозах [13]. В исследованиях на здоровых добровольцах и на 52 больных ишемической болезнью сердца введение препарата не сопровождалось клинически значимыми побочными эффектами и отклонениями лабораторных показателей [14]. Принимая во внимание важную роль МСР-1 в патогенезе и прогрессировании почечного повреждения (как гломерулярного, так и тубулоинтерстициального), представляется актуальным исследование действия ингибиторов МСР-1 на больных с протеинурическими формами ХГН.
Исследование препарата при протеинурических формах хронического гломерулонефрита проводилось в соответствии с действующим законодательством (разрешение Министерства здравоохранения и социального развития РФ № 720 от 16.02.2012, разрешение Совета по этике при Министерстве здравоохранения и социального развития РФ № 34 от 08.02.2012, протокол межвузовского комитета по этике № 02-12 от 14.03.2012).
Цель исследования: оценить эффективность, безопасность и переносимость нового отечественного противовоспалительного препарата – ингибитора действия МСР-1 у больных протеинурическими формами хронического гломерулонефрита.
Материал и методы
 Обследованы 7 больных различными формами ХГН: 1 женщина и 6 мужчин в возрасте 31 [24; 57] года. Все больные были с активным течением (обострением) ХГН, которым возможно было отсрочить патогенетическое лечение кортикостероидами и цитостатиками минимум на 3 месяца без высокой вероятности ухудшения. Каждый пациент подписывал информированное согласие на участие в исследовании.
Обследованы 7 больных различными формами ХГН: 1 женщина и 6 мужчин в возрасте 31 [24; 57] года. Все больные были с активным течением (обострением) ХГН, которым возможно было отсрочить патогенетическое лечение кортикостероидами и цитостатиками минимум на 3 месяца без высокой вероятности ухудшения. Каждый пациент подписывал информированное согласие на участие в исследовании.
Морфологически диагноз был подтвержден в отношении 6 больных: у 2 выявлен мезангиопролиферативный ГН, у 1 – мезангиокапиллярный ГН, у 1 – мембранозная нефропатия, у 1 – минимальные изменения, у 1 – фокальный сегментарный гломерулосклероз.
Выраженность фиброза в интерстиции почки оценивали в баллах: 1 – единичные очаги фиброза интерстиция, 2 – наличие множественных очагов фиброза интерстиция, 3 – наличие диффузного фиброза интерстиция.
Трое пациентов страдали умеренным нефротическим синдромом (НС): ПУ составляла в среднем 2,5 [2,46; 5,28] г/сут, альбумин – 29 [27,6; 30] г/л, у двух пациентов НС сочетался с умеренной эритроцитурией до 20 в п/зр. Функция почек у этих больных была сохранна: креатинин – 0,68 [0,64; 0,7...












