Фарматека №6 / 2025
Оксалиплатин-индуцированная периферическая невропатия как фактор влияния на показатели эффективности схемы mFOLFOX6 у больных метастатическим колоректальным раком. Ретроспективное исследование
1) Городской клинический онкологический диспансер, Санкт-Петербург, Россия;
2) Санкт-Петербургский государственный университет», Санкт-Петербург, Россия;
3) Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Обоснование: Оксалиплатин является важной составляющей схем химиотерапии (ХТ) первой линии при метастатическом колоректальном раке (мКРР), однако его применение часто ограничено развитием периферической невропатии (ПН). Вопрос оптимального уровня дозовой интенсивности (RDI – relative dose intensity), при котором достигается баланс между эффективностью и токсичностью, остается нерешенным.
Цель исследования: изучение влияния RDI оксалиплатина на частоту развития ПН и показатели эффективности лечения у пациентов с мКРР.
Материалы и методы: Проведено ретроспективное одноцентровое когортное исследование. Включены электронные истории болезни 142 пациентов с мКРР, получавших ХТ по схеме mFOLFOX6. Изучено влияние уровня RDI оксалиплатина на развитие невропатии (≥2-й степени), частоту объективного ответа, время без прогрессирования (ВБП) и общую выживаемость (ОВ). Оценка связи проводилась с использованием логистической регрессии, анализа Каплана–Майера и ROC-анализа. Средняя длительность наблюдения составила 36 месяцев.
Результаты: Установлено, что RDI≥78,9% достоверно ассоциирован с более высокой частотой развития оксалиплатин-индуцированной ПН≥2 степени (OШ=8,25, 95% ДИ: 2,56–26,62; p=0,0004). Влияния высокой дозовой интенсивности на ВБП (ОР=1,24; p=0,276) и ОВ (ОР=0,87; p=0,561) не выявлено, как и на частоту объективных ответов.
Заключение: Более высокая RDI оксалиплатина ассоциирована с повышенным риском невропатии, при этом не приводит к улучшению показателей выживаемости, что подтверждает обоснованность индивидуальной редукции дозы.
Введение
В настоящее время онкологические заболевания являются одной из основных причин смертности и инвалидности населения. Лидирующую позицию занимает метастатический колоректальный рак (мКРР). Несмотря на значительные успехи в диагностике и лечении первичных опухолей, мКРР остается серьезной проблемой для здравоохранения во всем мире [1, 2].
Оксалиплатин является одним из наиболее эффективных препаратов для лечения КРР [3]. Несмотря на достижения в области фармакотерапии, оксалиплатин-индуцированная периферическая невропатия (ОИПН) остается неразрешенной проблемой, ограничивающей применение оксалиплатина и снижающая качество жизни пациентов [4]. И хотя ОИПН является хорошо известным побочным эффектом оксалиплатина, многие аспекты этого явления остаются недостаточно изученными. В частности, не до конца понятны механизмы развития ОИПН и способы ее профилактики [5, 6]. Дозовая интенсивность (RDI – raletive dose intensity) оксалиплатина играет ключевую роль в развитии ОИПН. Она определяет количество лекарственного вещества, которое поступает в организм пациента за определенный период времени. От нее зависит эффективность и безопасность лечения, а также вероятность развития побочных эффектов. Изучение влияния RDI на исходы лечения мКРР имеет большое значение для оптимизации терапии и улучшения результатов лечения пациентов. Исследования показывают, что увеличение дозы препарата может повышать риск развития невропатии. В то же время снижение RDI может уменьшить вероятность возникновения этого побочного эффекта, но, как это может отразиться на эффективности системного противоопухолевого лечения в реальной клинической практике, предстоит изучить [7–9].
Цель исследования: оценить влияние RDI оксалиплатина на частоту развития периферической невропатии (ПН) и показатели эффективности лечения у пациентов с мКРР.
Материалы и методы
Проведено ретроспективное одноцентровое когортное исследование. Для нерандомизированного ретроспективного исследования были использованы данные амбулаторных карт и историй болезней электронной системы медицинской документации «Эконбол» СПб ГБУЗ «Городской клинический онкологический диспансер» (ГКОД). В ретроспективный анализ были включены 142 пациента, которые получили системное противоопухолевое лечение и продолжали динамическое наблюдение после него в ГКОД с января 2017 по февраль 2023 г. Февраль 2023 г. выбран периодом контроля для получения информации о выживаемости пациентов и симптомах ОИПН. Общий период наблюдения составил 61 месяц.
Основные критерии включения: возраст старше 18 лет, КРР IV стадии, отсутствие химиотерапии (ХТ) в анамнезе, соматический статус по шкале ECOG 0–2 на момент начала первой линии по схеме mFOLFOX6±таргетная терапия (анти-EGFR/aнти-VGF препаратами), отсутствие сахарного диабета или иных сопутствующих заболеваний, влияющих на состояние периферических нервных окончаний и их функцию.
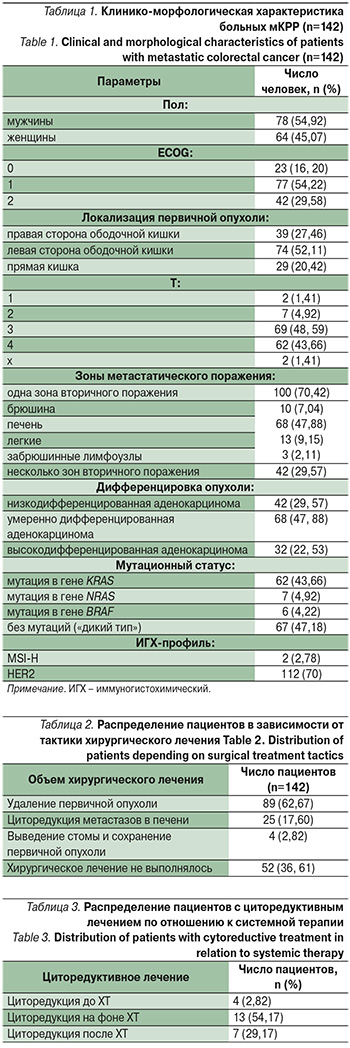
В группе исследованных пациентов 78 (54,92%) человек составили мужчины, 64 (45,07%) – женщины. Средний возраст составил 62,64±9,61 (95% доверительный интервал – ДИ: 60,63–64,66). Согласно классификации Всемирной организации здравоохранения 2016 г., число пациентов молодого возраста (18–44 года), включенных в исследование, составило 4 (2,81%) человека, пациентов среднего возраста (45–59 лет) – 40 (28,16 %) человек, пациентов пожилого возраста (60–74 года) – 86 (60, 56%) человек, число пациентов старческого возраста (75–90 лет) – 12 (8,45%) человек, долгожителей (старше 90 лет) в выборке не оказалось.
Правостороннюю локализацию первичной опухоли имели 39 (27,46%) человек, левостороннюю локализацию – 74 (52,11%) человека, 29 (20,42%) пациентов были с диагнозом рак прямой кишки. Стадирование заболевания было выполнено всем пациентам после верификации первичной опухоли и инструментального обследования посредством проведения компьютерной или магнитно-резонансной томографии в соответствии с классификацией TNM (7-я, 8-я редакции).
В исследуемой группе пациентов с высокодифференцированной аденокарциномой было 32 (22,53%) человека, с умеренно дифференцированной – 68 (47,88%) человек, с низкодифференцированной – 42 (29,57%) человека. Мутационный статус опухолей был определен всем пациентам на этапе первичного обращения в ГКОД: мутация в гене KRAS была обнаружена у 62 (43,66%) человек, в гене NRAS – у 7 (4,92%) человек, в гене BRAF – у 6 (4,22%) человек, у 67 (47,18%) человек мутаций в опухоли не было выявлено.
Опухолевый материал был исследован на предмет наличия нарушений компонентов белков системы репарации неспаренных нуклеотидов ДНК, обеспечивающих микросателлитную нестабильность, в 112 (78,87%) случаях: микросателлитная нестабильность выявлена у 2 (2,78%) человек. Из 70 опухолей, исследованных на предмет наличия экспрессии HER2/neu, положительных результатов не было.
Клинико-морфологическая характеристика больных мКРР, включенных в исследование, отражена в табл. 1.