Урология №3 / 2023
Опыт выполнения робот-ассистированной радикальной простатэктомии у пациентов после трансплантации сердца
Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр им. В. А. Алмазова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
Введение. Рак предстательной железы сохраняет за собой значимые позиции в структуре онкологической заболеваемости и смертности и является актуальной проблемой современной онкоурологии.
У реципиентов после трансплантации органов в связи с приемом иммунносупрессоров риск возникновения агрессивных форм рака возрастает, что обусловливает необходимость активного лечения таких пациентов. В мире недостаточно данных по радикальному лечению рака предстательной железы у пациентов после трансплантации сердца (ТС), в особенности по хирургическому лечению. Мы представляем первый в России и в Восточной Европе опыт проведения трех робот-ассистированных радикальных простатэктомий по поводу локализованного рака предстательной железы (РПЖ) у пациентов после перенесенной ТС.
Материалы и методы. Операции были выполнены в период с февраля 2021 по ноябрь 2021 г. в ФГБУ «НМИЦ им В. А. Алмазова» Минздрава России. Подготовка к операции, а также ведение больных в послеоперационном периоде осуществлялись совместно урологами и кардиологами-трансплантологами.
Результаты. Представлены основные демографические, периоперационные показатели, а также онкологические и неонкологические результаты. Все пациенты были выписаны из стационара в удовлетворительном состоянии. За период наблюдения не было зафиксировано биохимических рецидивов РПЖ. Ранние показатели удержания мочи у всех троих пациентов удовлетворительные. Заключение. Таким образом, выполнение робот-ассистированной радикальной простатэктомии у пациентов после ТС является технически выполнимым, эффективным и безопасным методом лечения рака предстательной железы. Необходимо выполнение исследований с более длительным периодом наблюдения, а также сравнительных исследований.
Введение. Рак предстательной железы (РПЖ) представляет собой актуальную проблему современной онкоурологии, сохраняя за собой лидирующие позиции в структуре заболеваемости злокачественными новообразованиями по всему миру; отмечается тенденция роста показателя заболеваемости РПЖ [1–5]. У пациентов, перенесших трансплантацию сердца (ТС), онкологические заболевания являются наиболее частой причиной смерти, поскольку обязательное применение препаратов, вызывающих иммуносупрессию у пациентов после ТС, повышает риск развития злокачественных новообразований [6, 7]. На онкогенез после ТС влияет множество механизмов, в том числе снижение иммунореактивности пациента из-за хронической иммуносупрессии, повышенное влияние онкогенных вирусов, интенсивность и продолжительность иммуносупрессии [8].
Основные методы лечения локализованного РПЖ включают активное наблюдение, лучевую терапию (брахитерапию и дистанционную лучевую терапию) с гормональной терапией или без нее и хирургическое вмешательство [9]. Вместе с тем большинство лечебных воздействий, которые применяются при онкологических заболеваниях, могут возыметь нежелательные последствия у пациентов после ТС. В частности, препараты для андроген-депривантной терапии, химиопрепараты различных групп имеют кардиотоксичное действие, что обусловливает ограничение их применения у больных после ТС [10]. На сегодняшний день отсутствуют крупные исследования, в которых изучались бы преимущества какого-либо из этих методов лечения у пациентов с пересаженным сердцем и РПЖ.
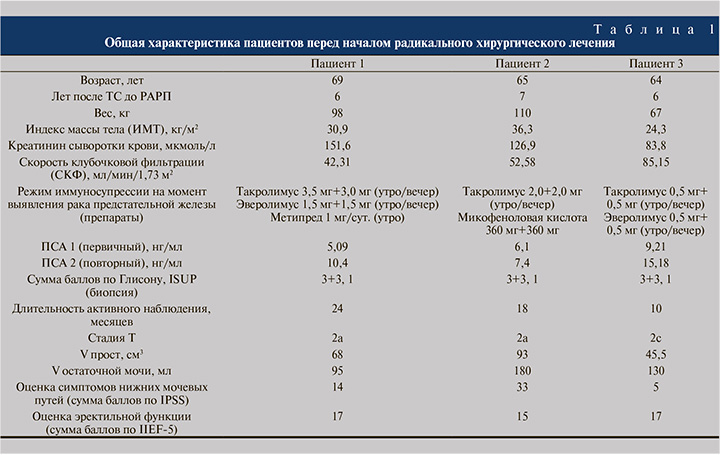
Материалы и методы. За период с февраля 2021 по ноябрь 2021 г. в НМИЦ им В. А. Алмазова были выполнены три робот-ассистированные радикальные простатэктомии по поводу локализованного РПЖ у пациентов после перенесенной ТС. Всем пациентам была осуществлена ортотопическая ТС по бикавальной методике в условиях экстракорпорального кровообращения. У всех больных был ишемический генез хронической сердечной недостаточности. Одному пациенту операция выполнена в 2014 г., двум другим – в 2015 г. Поддерживающая иммуносупрессивная терапия включала применение ингибиторов кальциневрина (n=3; такролимуса), антиметаболитов (n=1; микофеноловая кислота), блокаторов mTOR (mammalian target of rapamycin) (n=2; эверолимус) и глюкокортикостероидов (n=1; метилпреднизолон). Несмотря на диагностированную онкопатологию, один из пациентов продолжил получать микофеноловую кислоту в связи с наличием в анамнезе нежелательного явления на применение эверолимуса. При плановом обследовании у всех больных выявлено повышение уровня простатоспецифического антигена (ПСА), в связи с чем после дообследования (ультразвуковое исследование [УЗИ] малого таза, магнитно-резонансная томография/мультиспиральная компьютерная томография [МРТ/МСКТ] малого таза) была выполнена трансректальная мультифокальная биопсия предстательной железы, гистологически верифицирована аденокарцинома. Также во всех случаях выполнялась позитронно-эмиссионная томография (ПЭТ)/КТ всего тела с 68Ga-простат-специфическим мембранным антигеном (ПСМА). На момент установки диагноза у всех троих пациентов имел место локализованный процесс низкого риска, в связи с чем консилиумом было принято решение об активном наблюдении. Во всех трех случаях за период наблюдения (10–24 мес.) зафиксировано повышение уровня ПСА в динамике, в связи с чем пациентам предложено радикальное лечение. С учетом большого количества остаточной мочи у всех троих пациентов лучевые методы лечения не рассматривались и была избрана тактика оперативного вмешательства в объеме робот-ассистированной радикальной простатэктомии (РАРП). Основные демографические и предоперационные показатели представлены в табл. 1.
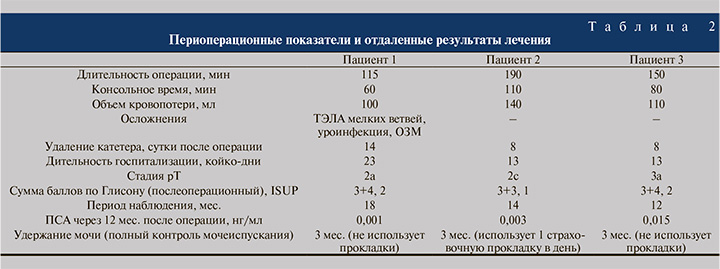
Результаты. Все пациенты были госпитализированы за 3–4 дня до планируемой операции. Подготовка к операции, а также курация пациентов осуществлялись совместно урологами и кардиологами-трансплантологами. В рамках подготовки перед операцией была выполнена редукция иммуносупрессивной терапии (пропуск микофеноловой кислоты/эверолимуса) с вечера накануне операции и в день хирургического вмешательства. Также временно отменен прием антиагрегантов (n=2) и новых оральных антикоагулянтов (n=1) с последующим назначением подкожных инъекцией эноксапарина натрия. После стабилизации состояния пациентов и отмены антикоагулянтов прямого действия возобновлен прием антиагрегантов или апиксабана. Основные периоперационные показатели изложены в табл. 2.
Пациент 1:
Пациент В. 69 лет в 2015 г. перенес ТС по бикавальной методике по поводу ишемической болезни сердца (ИБС), постинфарктного кардиосклероза (ПИКС) (о...












