Клиническая Нефрология №2 / 2018
Отдаленные клинические результаты применения фотофереза в качестве профилактики отторжения почечного аллотрансплантата
Хирургическое отделение трансплантологии и диализа Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, Москва, Россия
в сочетании с фотоферезом.
Материал и методы. Было проведено открытое когортное рандомизированное исследование. Обследованы 60 реципиентов почечного аллотрансплантата, полученного от 30 посмертных доноров. Пациенты были случайным образом рандомизированы в 2 группы. Все трансплантаты были парные, причем одну почку получал пациент основной группы, другую – группы сравнения. Тридцать пациентов основной группы получили стандартную иммуносупрессию (такролимус, микофенолаты, преднизолон) и 10–15 сеансов фотофереза в течение первых 6 месяцев после трансплантации. Тридцать пациентов группы сравнения получили только стандартную иммуносупрессию. Пациенты на момент включения не различались по основным клиническим показателям. Срок наблюдения составил от 2 до 7 лет, в среднем 4,5±2,0 года. Конечные точки: основная –
утрата трансплантата (включая смерть реципиента с функционирующим трансплантатом), суррогатные – число кризов отторжения, динамика концентрации креатинина в крови, скорости клубочковой фильтрации и суточной протеинурии.
Результаты. Функция почечного аллотрансплнатата была лучше в основной группе: ниже – средняя концентрация сывороточного креатинина (p=0,017), меньше – суточная протеинурия (p=0,027) и выше – скорость клубочковой фильтрации (p=0,013). Отторжение было выявлено у двух пациентов основной группы (три эпизода) и у семи пациентов группы сравнения (восемь эпизодов). Относительный риск отторжения в основной группе был значительно ниже, чем в группе сравнения: 0,2509 (95% ДИ – 0,05386–0,9167; р=0,0358). Риск утраты трансплантата также был ниже в основной группе: 0,2782 (95% ДИ – 0,07562–0,8657; p=0,026). Выживаемость трансплантатов была выше в основной группе (Log Rank р=0,009; Breslow р=0,005).
Заключение. Фотоферез является эффективным методом профилактики отторжения трансплантата: улучшает показатели функции в отдаленном посттрансплантационном периоде, снижает риск развития отторжения.
Введение
Несмотря на постоянное совершенствование протоколов иммуносупрессивной терапии, отторжение по-прежнему остается одной из основных причин утраты трансплантата в отдаленном периоде. К концу 1-го года после трансплантации почки число функционирующих трансплантатов составляет около 90%, к 5 годам снижается до 70%, к 10–15 – еще до 50% [1]. Одним из эффективных методов лечения стероидрезистентного отторжения является фотоферез (ФФ).
ФФ – это метод клеточной иммунотерапии, при котором из крови больного выделяют мононуклеарные клетки крови, сенсибилизируют 8-метоксипсораленом, затем, подвергая длинноволновому ультрафиолетовому облучению, возвращают обратно больному. ФФ впервые был предложен Richard Edelson в 1987 г. для терапии Т-клеточной лимфомы кожи [2]. Дальнейшее изучение данного метода показало его высокую эффективность при терапии псориаза, системной склеродермии, купировании реакции «трансплантат против хозяина», ревматоидном артрите и в ряде других заболеваний [3–5].
Данный метод показал высокую эффективность в лечении кризов острого и хронического отторжения при трансплантации сóлидных органов [5]. Высокая клиническая эффективность ФФ характеризуется прежде всего отсутствием тотальной иммуносупрессии, также при проведении данного метода не было выявлено развития каких-либо специфических осложнений. Многоцентровые исследования, посвященные использованию данного метода при трансплантации сердца, легких и стволовых кроветворных клеток, позволили рекомендовать ФФ в качестве терапии 2-й линии при развитии отторжения трансплантированных органов [4, 6].
Включение данного метода в стандартный иммуносупрессивный протокол на ранних этапах после трансплантации почки показало хорошие клинические результаты в течение первых 6 месяцев наблюдения [7].
Предполагается, что применение ФФ при трансплантации сóлидных органов способно приводить к формированию частичной иммунологической толерантности [4, 8]. По-прежнему остаются неясными длительность толерогенного эффекта этого метода в отдаленном посттрансплантационном периоде и функциональные особенности почечного трансплантата.
Материал и методы
Было проведено открытое когортное рандомизированное исследование, в которое были включены 60 пациентов с хронической болезнью почек 5Д-стадии. Всем пациентам была выполнена одногруппная трупная трансплантация почки. Пациенты были случайным образом рандомизированы в две группы. Все трансплантаты были парными, причем одну почку получал пациент основной группы, другую – группы сравнения. Тридцать пациентов основной группы получали стандартную иммуносупрессию и 10–15 сеансов ФФ в течение первых 6 месяцев после трансплантации. Пациенты группы сравнения получали только иммуносупрессивную терапию.
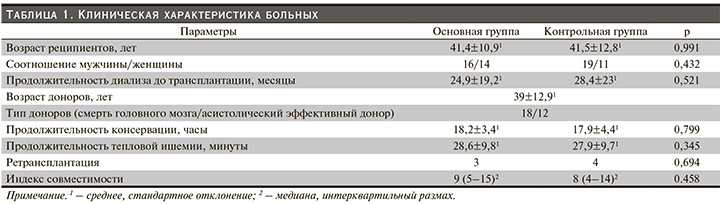
Конечные точки: основная – утрата трансплантата, суррогатные – число кризов отторжения, динамика концентрации креатинина в крови, скорости клубочковой фильтрации (СКФ) и суточной протеинурии.
Пациенты на момент включения не различались по основным клиническим показателям (табл. 1). В основе развития хронической болезни собственных почек на первом месте был хронический гломерулонефрит – 17 пациентов основной группы и 17 – группы сравнения, на втором месте – гипертонический нефросклероз у 5 и 2, на третьем – поликистоз почек у 2 и 4, на четвертом – хронический пиелонефрит у 2 и 2, на пятом месте – аномалия развития мочевой системы у 1 и 3 соответственно. Причиной хронической болезни почек для 3 пациентов основной группы послужила диабетическая нефропатия, для 2 пациентов группы сравнения – антифосфолипидный синдром. Срок наблюдения за пациентами составил от 1 до 7 лет, в среднем 4,5±2,0 года.
Развитие отторжения у пациентов с почечным аллотрансплантатом (ПАТ) мы оценивали по клинико-лабораторной симптоматике (внезапному повышению уровня креатинина, суточной протеинурии, снижению СКФ) при исключении иных причин дисфункции ПАТ, а также при проведении морфологического исследования. Всем больным выполнены протокольные биопсии через полгода после трансплантации, а также биопсии on demand при развитии дисфункции. Морфологическую оценку патологии ПАТ провели согласно международной классификации Banff 2007 г. [9].
Иммуносупрессивная терапия. Индукция осуществлена базиликсимабом в дозе 20 мг внутривен...












